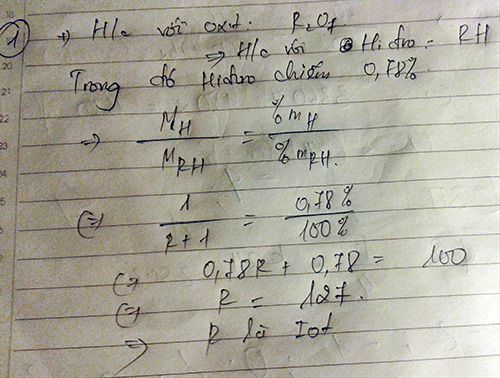Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1.
Đặt công thức oxit là A2On (với n = 1, 2, …, 7)
%mA =\(\frac{2A}{2A+16n}\).100% = 52,94%
→ 0,9412A = 8,4704n
→ A = 9n
Bài 2:
Công thức oxit cao nhất là R2On → %mR = \(\frac{2R}{2R+16n}\text{.100%}\)
Công thức hợp chất khí với H là RH8-n → %mR =\(\frac{R}{R+8-n}.100\%\)
Theo đề bài tỉ lệ thành phần phần trăm của R trong oxit cao nhất và trong hợp chất khí với H là 0,5955 nên suy ra:\(\frac{\frac{2R}{2R+16n}}{\frac{R}{R+8-n}}=0,5955\)
\(\rightarrow\frac{2R\left(R+8-n\right)}{R\left(2R+16n\right)}=0,5955\)
\(\rightarrow\frac{2\left(R+8-n\right)}{\left(2R+16n\right)}=0,5955\)
\(\rightarrow0,809R=11,528n-16\rightarrow R=\frac{11,528n-16}{0,809}\)
Do R là phi kim nên n = 5, 6, 7 thay vào thấy với n = 7; R = 80 thỏa mãn
Vậy R là Brom (Br)
Bài 3 :
Đặt công thức 2 oxit trên là RxOy và RaOb
Ta có
\(\frac{Rx}{16y}=\frac{7}{12}\)\(\rightarrow\)Rx=\(\frac{28y}{3}\)⇒R=\(\frac{28y}{3x}\)=\(\frac{14}{3}.\frac{2y}{x}\) (với 2y/x là hóa trị của R)
Lập bảng biện luận hóa trị\(\rightarrow\) Với \(\frac{2y}{3}\)=3>R=14(R là Nito)
\(\frac{2y}{x}\)=3thì 2y=3x\(\rightarrow\frac{x}{y}=\frac{2}{3}\)
Do đó CTHH RxOy là N2O3
RaOb \(\Leftrightarrow\)NaOb
R chiếm \(\frac{y}{11}\) mới đúng nhé
Ta có \(\frac{14a}{16b}\)=\(\frac{7}{4}\)\(\rightarrow\)56a=112b\(\rightarrow\frac{a}{b}=\frac{2}{1}\)
Do đó CTHH NaOb là N2O
Bài 4 :
2X+2H2O\(\rightarrow\)2XOH+H2
nH2=\(\frac{3,36}{22,4}\)=0,15(mol)
\(\rightarrow\)MX=\(\frac{8,5}{0,3}\)=28,333
\(\rightarrow\) 2 kim loại là Na và K

Bài 1
Gọi mol X là x, mol Y là Y
n\(_{H2}=\frac{5,6}{22,4}=0,25\left(mol\right)\)
2X+2xH2O--->2X(OH)x+xH2
n\(_{OH}=2n_{H2}=0,5\left(mol\right)\)=> \(x+2y=0,5\rightarrow\frac{x}{2}+y=0,25\)
=> M\(_{tb}=\frac{7,1}{x+y}\rightarrow\frac{7,1}{x+2y}< M_{tb}< \frac{7,1}{\frac{x}{2}+y}\)
=> 14,2<Mtb<28
=> X có thể là Na,Y có thể là Mg
Bài 3
oxit cao nhất của chu kỳ 2 là N2O5
Oxxit cao nhất của chu kỳ 3 là R2O5
Bài 4
CTHH: RO3
Theo bài ta có
\(\frac{48}{R+48}.100\%=60\)
=>\(\frac{48}{R+48}=0,6\rightarrow48=0,6R+28,8\)
=> \(0,6R=19,2\rightarrow R=32\)lưu huỳnh
=>CTHH:SO3
Bài 5
CTHH: Y2O3
Theo bài ta có
\(\frac{2Y}{2Y+48}=38,8\rightarrow\frac{2Y}{2Y+112}=0388\)
= \(2Y=0,776Y+18,624\)
=>\(1,224Y=18,624\)
=>Y=14(Ni tơ)
CTHH:N2O3
Bài 6
CTHH:RO
Theo bài
\(\frac{R}{R+16}.100\%=10,46\rightarrow\frac{R}{R+16}=0,1046\)
=> R=0,1046R+1,67
=>0,8954R=1,67
Xem lại đề
Câu 1:
Giả sử chỉ KL kiềm tác dụng vs HCl
\(n_{KL}=\text{2. nH2=0,5}\Rightarrow PTK_{tb}=\text{m hh/ 0,5=14,2}\)
Giả sử chỉ cs KL kiềm thổ ác dụng
n Kiềm thổ =n H2 =0,25 ---> PTK trung bình< mhh/0,25=28,4
2KL đó là Na và Mg
Câu 2
\(\text{GỌi Ct chung của 2 KL đó là A}\)
PTK trung bình của A = 18/0,5=36----> 2 Kl đó là Mg và Ca

Đổi 896 cm3 = 0,896 lít
=> nH2 = 0,896 / 22,4 = 0,04 mol
Đặt công thức hóa học chung của 2 kim loại kiềm thổ là \(\overline{M}\)
PTHH: \(2\overline{M}+2H_2O\rightarrow2\overline{M}OH+H_2\)
0,08.........................................0,04
=> \(M_{\overline{M}}=\frac{2,16}{0,08}=27\left(\frac{g}{mol}\right)\)
=> Hai kim loại kiềm đó là Na và K
b/ Gọi số mol K, Na lần lượt là x, y (mol)
PTHH
2K + 2H2O ===> 2KOH + H2
x.............................................0,5x
2Na + 2H2O ===> 2NaOH + H2
y ................................................y
Theo đề ra, ta có hệ phương trình:
\(\begin{cases}39x+23y=2,16\\0,5x+0,5y=0,04\end{cases}\)
=> \(\begin{cases}x=0,02\\y=0,06\end{cases}\)
=> mNa = 0,06 x 23 = 1,38 gam
mK = 0,02 x 39 = 0,78 gam
=> %mNa = \(\frac{1,38}{2,16}.100\%=63,89\%\)
%mK = 100% - 63,89% = 36,11%
c/

Câu 1:
Hợp chất KHí với Hidro: RH2
\(\Rightarrow\) Ngtố ∈ nhóm VIA \(\Rightarrow\) Oxit cao nhất: RO3
%O = 60% \(\Rightarrow\)%R = 40%
\(\Rightarrow\)\(\dfrac{\%R}{\%O}\)=\(\dfrac{1.M_R}{3.M_O}\)\(\Rightarrow\)\(\dfrac{\text{40%}}{60\%}\)=\(\dfrac{M_R}{3.16}\)\(\Rightarrow\)MR= 32 g/mol
\(\Rightarrow\)Ngtố S
b) Ta có C% =\(\dfrac{m_{ct}}{m_{dd}}\).100 \(\Rightarrow\)mct=\(\dfrac{C\%.m_{dd}}{100}\)= \(\dfrac{19,6.100}{100}\)=19,6 g
Mà mdd= mct + mdung môi \(\Rightarrow\)mdung môi=mdd - mct = 100 - 19,6 = 80,4g
Câu 2 THÌ MÌNH LƯỜI QUÁ :))

a)
nH2 = 0,18 mol
Đặt công thức chung của 2 KL là R
PTHH: R + H2O → ROH + \(\frac{1}{2}\) H2
______0,36 _________ 0,36_0,18 (mol)
→ MR = \(\frac{10,2}{0,36}\) = 28,33
Do 2 KL kế tiếp thuộc nhóm IA nên là Natri (M=23) và Kali (M=39)
b)
Trung hòa hết ROH:
2ROH + H2SO4 → R2SO4 + 2H2O
0,36____0,18 (mol)
→ mH2SO4 = 0,18.98 = 17,64 gam
→ m dd H2SO4 = 17,64.\(\frac{100}{12}\) = 147 gam
→ V dd H2SO4 = \(\frac{147}{1,03}\) ≈ 142,72 ml