Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

X tạo bởi chất ion với clo có công thức là XC1, vậy X là kim loại có hoá trị I.
Y cùng số nhóm với X vậy cũng có hoá trị I, công thức clorua của nó là YC1.
Ta có:
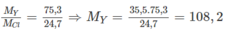
( M Y và M Cl lần lượt là NTK của nguyên tố Y và nguyên tố clo). Đó là Ag. Nguyên tố X cùng chu kì, cùng số thứ tự nhóm với Ag là kali (K))

D
Vì
![]()
nên X và Y là những nguyên tố thuộc chu kì nhỏ.
X và Y là 2 nguyên tố thuộc 2 nhóm kế tiếp
=> Số proton của X và Y hơn kém nhau 1 hoặc 7 hoặc 9.
Ta xét từng trường hợp:
Nếu
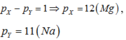
Ở trạng thái đơn chất hai nguyên tố này không phản ứng với nhau(loại).
Nếu
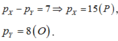
Ở trạng thái đơn chất hai nguyên tố này phản ứng được với nhau (nhận).
Nếu
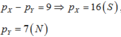
Ở trạng thái đơn chất hai nguyên tố này không phản ứng với nhau(loại).
Vậy X là P.



câu 1 :
\(R\left(OH\right)_2+2HCl\rightarrow RCl_2+2H_2O\)
Ta có : \(n_{R\left(OH\right)_2}=n_{RCl_2}\)
⇔ \(\dfrac{m}{M_{R\left(OH\right)_2}}=\dfrac{m}{M_{RCl_2}}\)
⇔ \(\dfrac{8,70}{M_R+17.2}=\dfrac{14,25}{M_R+35,5.2}\)
⇔ \(M_R\)= 24 (g/mol)
Vậy phân tử khối của R là 24g/mol
Câu 2 :
Ta có : \(\left\{{}\begin{matrix}Z_X-Z_Y=1\\2Z_X+Z_Y=23\end{matrix}\right.\)⇔ \(\left\{{}\begin{matrix}Z_X=8\\Z_Y=7\end{matrix}\right.\)
Vậy số hiệu nguyên tử của X là 8