Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a) 4P+ 5O_2 \xrightarrow{t^o} 2P_2O_5\\ b) n_{O_2} = \dfrac{1,12}{22,4} = 0,05(mol)\\ n_{P_2O_5} = \dfrac{2}{5}n_{O_2} = 0,02(mol)\\ m_{P_2O_5} = 0,02.142 = 2,84(gam) c) 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ n_{KClO_3} = \dfrac{2}{3}n_{O_2} = \dfrac{0,1}{3}(mol)\\ m_{KClO_3} = \dfrac{0,1}{3}122,5 = 4,083(gam)\)

a, \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
b, \(n_P=\dfrac{1,55}{31}=0,05\left(mol\right)\)
\(n_{O_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,05}{4}>\dfrac{0,05}{5}\), ta được P dư.
c, Theo PT: \(n_{P\left(pư\right)}=\dfrac{4}{5}n_{O_2}=0,04\left(mol\right)\Rightarrow n_{P\left(dư\right)}=0,05-0,04=0,01\left(mol\right)\)
\(\Rightarrow m_{P\left(dư\right)}=0,01.31=0,31\left(g\right)\)

a, \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
b, Ta có: \(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
\(n_{O_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,4}{4}< \dfrac{0,4}{3}\), ta được O2 dư.
Theo PT: \(n_{O_2\left(pư\right)}=\dfrac{3}{4}n_{Al}=0,3\left(mol\right)\Rightarrow n_{O_2\left(dư\right)}=0,4-0,3=0,1\left(mol\right)\)
\(\Rightarrow V_{O_2\left(dư\right)}=0,1.22,4=2,24\left(l\right)\)
Lập phương trình hóa học:
Al+O2---->Al2O3
4Al+3O2---->2AlO3
Áp dụng đinh luật bảo toàn khối lượng ta có:
mAl + mO2=mAl2O3
=>mO2=mAl2O3 - mAl
=>mO2=20,4 - 10,8=9,6(g)
Số mol của 9,6g khí oxi là:
ADCT: n=m\M=>nO2=9,6\32=>nO2=0,3(mol)
n=V\22,4=>VO2=nO2 . 22,4=0,3 . 22,4=6,72(l)

\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{19,5}{65}=0,3mol\)
\(Zn+\dfrac{1}{2}O_2\rightarrow\left(t^o\right)ZnO\)
1 1/2 1 (mol)
0,3 0,15 0,3 ( mol )
PƯ trên thuộc loại phản ứng hóa hợp
\(m_{ZnO}=n_{ZnO}.M_{ZnO}=0,3.81=24,3g\)
\(V_{O_2}=n_{O_2}.22,4=0,15.22,4=3,36l\)

a/ Ta có: \(n_{Mg}=\dfrac{4.8}{24}=0.2\left(mol\right)\)
PTHH:
\(2Mg+O_2\underrightarrow{t^o}2MgO\)
2 1
0.2 x
\(=>x=\dfrac{0.2\cdot1}{2}=0.1=n_{O_2}\)
\(=>V_{O_2\left(đktc\right)}=0.1\cdot22.4=2.24\left(l\right)\)
b/ \(2Mg+O_2\underrightarrow{t^o}2MgO\)
2 2
0.2 y
\(=>y=\left(0.2\cdot2\right):2=0.2=n_{MgO}\)
\(=>m_{MgO}=0.2\cdot\left(24+16\right)=8\left(g\right)\)

a)\(4Na+O2-->2Na2O\)
\(n_{Na}=\frac{18,4}{23}=0,8\left(mol\right)\)
\(n_{O2}=\frac{1}{4}n_{Na}=0,2\left(mol\right)\)
\(V_{O2}=0,2.22,4=4,48\left(l\right)\)
b)\(n_{Na2O}=\frac{1}{2}n_{Na}=0,4\left(mol\right)\)
\(m_{Na2O}=0,4.62=24,8\left(g\right)\)
c)\(2KMnO4-->K2MnO4+MnO2+O2\)
\(4Na+O2-->2Na2O\)
\(n_{KMnO4}=\frac{142,2}{158}=0,9\left(mol\right)\)
\(n_{O2}=\frac{1}{2}n_{KMnO4}=0,45\left(mol\right)\)
\(n_{Na}=\frac{18,4}{23}=0,8\left(mol\right)\)
Lập tỉ lệ
\(nNa\left(\frac{0,8}{4}\right)< n_{O2}\left(\frac{0,45}{1}\right)\)
=> O2 dư
\(n_{O2}=\frac{1}{4}n_{Na}=0,2\left(mol\right)\)
\(n_{_{ }O2}dư=0,45-0,2=0,25\left(mol\right)\)
\(m_{O2}dư=0,25.32=8\left(g\right)\)

Bài 1:
a) nFe = \(\frac{25,2}{56}= 0,45\) mol
Pt: 3Fe + ..2O2 --to--> Fe3O4
0,45 mol-> 0,3 mol
VO2 = 0,3 . 22,4 = 6,72 (lít)
b) Pt: CH4 + ....2O2 --to--> CO2 + 2H2O
......0,15 mol<-0,3 mol
mCH4 = 0,15 . 16 = 2,4 (g)
Bài 2:
a) nAl = \(\frac{5,4}{27}= 0,2\) mol
Pt: 4Al + 3O2 --to--> 2Al2O3
0,2 mol->0,15 mol-->0,1 mol
mAl2O3 = 0,1 . 102 = 10,2 (g)
b) VO2 = 0,15 . 22,4= 3,36 (lít)
Mà: VO2 = 20%Vkk = 0,2Vkk
=> Vkk = \(\frac{VO2}{0,2}=\frac{3,36}{0,2}=16,8 \) (lít)

a) nO2 = \(\frac{6,72}{22,4}=0,3\) mol
Pt: C + O2 --to--> CO2
..........0,3 mol---> 0,3 mol
mCO2 = 0,3 . 44 = 13,2 (g)
b) Pt: 2KClO3 --to--> 2KCl + 3O2
........0,2 mol<------------------0,3 mol
mKClO3 = 0,2 . 122,5 = 24,5 (g)
.

a) PTHH: 3Fe + 2O2 =(nhiệt)=> Fe3O4
b) Số mol Fe: nFe = \(\frac{11,2}{56}=0,2\left(mol\right)\)
Số mol O2: nO2 = \(\frac{22,4}{22,4}=1\left(mol\right)\)
c) Lập tỉ lệ : \(\frac{0,2}{3}< \frac{1}{2}\)
=> Fe hết, O2 dư
=> nO2(phản ứng) = \(\frac{0,2.2}{3}=\frac{2}{15}\left(mol\right)\)
=> nO2(dư) = \(1-\frac{2}{15}=\frac{13}{15}\left(mol\right)\)
=> mO2 = \(\frac{13}{15}.32=27,73\left(gam\right)\)
d) nFe3O4 = \(\frac{0,2}{3}=\frac{1}{15}\left(mol\right)\)
=> mFe3O4 = \(\frac{1}{15}.232=15,47\left(gam\right)\)
nFe= \(\frac{m_{Fe}}{M_{Fe}}=\frac{11,2}{56}=0,2\left(mol\right)\)
\(n_{O_2}=\frac{V_{O_2}}{22,4}=\frac{22,4}{22,4}=1\left(mol\right)\)
PTHH: 3Fe + 2O2 -to> Fe3O4
Theo PTHH và đề bài ta có:
\(\frac{n_{Fe\left(đềbài\right)}}{n_{Fe\left(PTHH\right)}}=\frac{0,2}{3}\approx0,067< \frac{n_{O\left(đềbài\right)}}{n_{O_2\left(PTHH\right)}}=\frac{1}{2}=0,5\)
=> Fe đã phản ứng hết và O2 dư nên tính theo nFe.
c) \(n_{O_2\left(phảnứng\right)}=\frac{2}{3}.n_{Fe}=\frac{2}{3}.0,2=0,133\left(mol\right)\)
\(n_{O_2\left(dư\right)}=n_{O_2\left(banđầu\right)}-n_{O_2\left(phảnứng\right)}=0,5-0,133=0,367\left(mol\right)\)
=> \(m_{O_2\left(dư\right)}=n_{O_2\left(dư\right)}.M_{O_2}=0,367.32\approx11,744\left(g\right)\)
d) Theo PTHH và đề bài, ta có:
\(n_{Fe_3O_4}=\frac{1}{3}.n_{Fe}=\frac{1}{3}.0,2\approx0,067\left(mol\right)\)
=> \(m_{Fe_3O_4}=n_{Fe_3O_4}.M_{Fe_3O_4}=0,067.232=15,544\left(g\right)\)
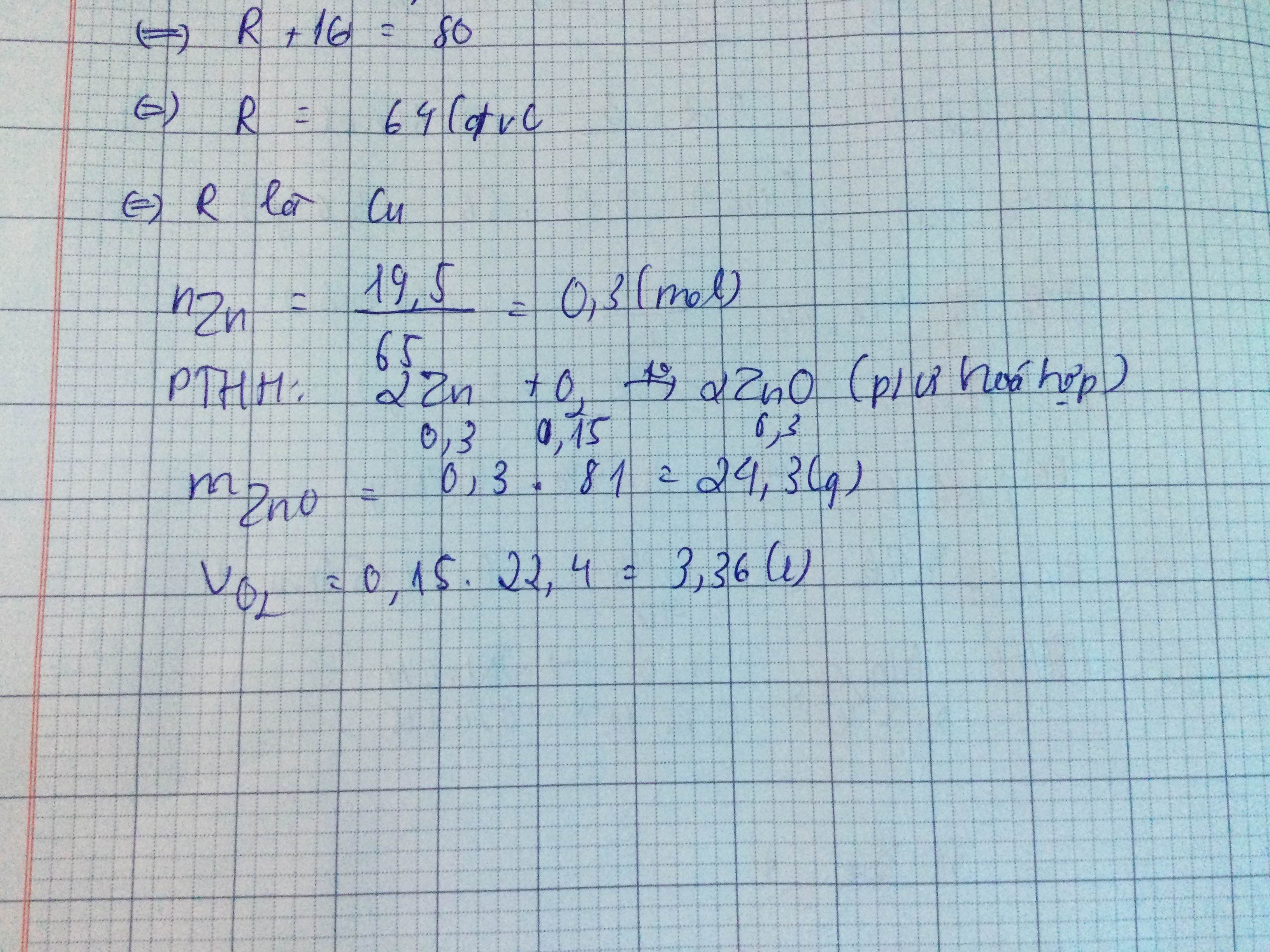
2Zn+O2-to>2ZnO
0,1---0,05----0,1
n Zn=0,1 mol
nO2=0,025 mol
=>VO2=0,05.22,4=1,12l
=>mZnO=0,1.81=8,1g
c)Zn dư
=>m ZnO=0,05.81=4,05g
2Zn+O2-to>2ZnO
0,1---0,05----0,1
n Zn=6,5/65=0,1 mol
n O2=0,8/32=0,025 mol
=>VO2=0,05.22,4=1,12l
=>mZnO=0,1.81=8,1g
c)Zn dư
=>m ZnO=0,05.81=4,05g