Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Al}=2a\left(mol\right)\end{matrix}\right.\left(a>0\right)\Rightarrow56a+27.2a=11\Leftrightarrow a=0,1\left(mol\right)\left(TM\right)\)
PTHH:
Al + 3AgNO3 ---> Al(NO3)3 + 3Ag
0,2->0,6--------->0,2---------->0,6
Fe + 2AgNO3 ---> Fe(NO3)2 + 2Ag
0,05<-0,1--------->0,05-------->0,1
=> \(m_{c.r\text{ắn}}=m_{Ag}+m_{Fe\left(d\text{ư}\right)}=0,7.108+0,05.56=78,4\left(g\right)\)
b) \(\left\{{}\begin{matrix}C_{M\left(Al\left(NO_3\right)_3\right)}=\dfrac{0,2}{0,7}=\dfrac{2}{7}M\\C_{M\left(Fe\left(NO_3\right)_2\right)}=\dfrac{0,05}{0,7}=\dfrac{1}{14}M\end{matrix}\right.\)

Tính toán theo PTHH :
Mg + CuSO4 → Cu + MgSO4
Mg + FeSO4 → Fe + MgSO4
Ba(OH)2 + MgSO4 → BaSO4 + Mg(OH)2
Ba(OH)2 + FeSO4 → BaSO4 + Fe(OH)2
Mg(OH)2 → MgO + H2O
2 Fe(OH)2 + ½ O2 → Fe2O3 + 2 H2O
Giả sư dung dịch muối phản ứng hết
=> n Fe = n FeSO4 = 0,2 . 1= 0,2 mol => m Fe = 0,2 . 56 = 11,2 g
=> n Cu =n CuSO4 = 0,2 . 0,5 = 0,1 mol => m Cu = 0,1 . 64 = 6,4 g
=> m chất rắn = 11,2 + 6,4 = 17,6 g > 12 g > 6,4
=> kim loại Fe dư sau phản ứng Vì CuSO4 phản ứng trước sau đó mới đến FeSO4 phản ứng
CuSO4 đã hết và phản ứng với 1 phần FeSO4
12 g = m Cu + m Fe phản ứng = 6,4 g + m Fe phản ứng
=> m Fe = 5,6 g => n Fe = 0,1 mol => n FeSO4 dư = 0,2 – 0,1 = 0,1 mol
Theo PTHH : n Mg = 0,1 + 0,1 = 0,2 mol ( bắng số mol CuSO4 và FeSO4 phản ứng )
Theo PTHH : n Mg = n MgSO4 = n Mg(OH)2 = n MgO = 0,2 mol
n FeSO4 dư = n Fe(OH)2 = n Fe2O3 . 2 = 0,1 mol
=> n Fe2O3 = 0,1 mol
=> m chất rắn = m Fe2O3 + m MgO = 0,1 . 160 + 0,2 . 40 = 24 g

a, 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
x…………3/2.x
Fe + CuSO4 → FeSO4 + Cu
y……..y
Al phản ứng hết với CuSO4 sau đó Fe mới phản ứng với CuSO4. Vì sau phản ứng thu được rắn Y gồm 2 kim loại nên Al đã tan hết và Fe có thể đã phản ứng 1 phần hoặc chưa phản ứng. 2 kim loại trong Y là Fe và Cu.
⇒ nCu = nCuSO4 = 0,2.1 = 0,2 mol
⇒ mFe dư = mY - mCu = 15,68 - 0,2.64 = 2,88g
Đặt số mol Al ban đầu là x, số mol Fe phản ứng là y, ta có hệ phương trình:
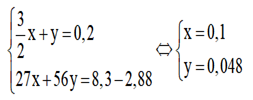
⇒ mAl = 0,1.27 = 2,7g
⇒ %mAl = 2,7/8,3.100 = 32,53%

Cu Ag Fe Al → O 2 , t 0 Y → HCldu A → NaOH kt → t 0 Z
– Tác dụng với oxi dư
2Cu + O2 →2CuO
4Fe + 3O2→2Fe2O3
4Al + 3O2 →2Al2O3
– Tác dụng với HCl dư
CuO +2HCl → CuCl2 + H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
– Tác dụng với NaOH dư
NaOH + HCl → NaCl + H2O
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
AlCl3 + 3NaOH → 2H2O + 3NaCl + NaAlO2
– Nung trong không khí
2Fe(OH)3 →Fe2O3 + 3H2O
Cu(OH)2→CuO + H2O
=> Z gồm CuO và Fe2O3

\(Mg>Fe\) => `Mg` phản ứng trước
\(Mg+Cu^{2+}\rightarrow Mg^{2+}+Cu^o\)
x----->x-------------------->x
\(Fe+Cu^{2+}\rightarrow Fe^{2+}+Cu^o\)
y----->y----------------->y
Giả sử nếu \(Cu^{2+}\) chuyển hết thành \(Cu^o\)
\(\Rightarrow n_{Cu^o}=n_{Cu^{2+}}=n_{kt}\)
Có \(n_{Cu^{2+}}=0,2.1=0,2\left(mol\right)\)
\(n_{kt}=\dfrac{15,6}{64}=0,24375\left(mol\right)>0,2\left(mol\right)\)
\(\Rightarrow\)Giả sử sai, kim loại Fe trong hỗn hợp X còn dư
Theo đề có: \(m_{Fe.dư}=m_{kt}-m_{Cu}=15,6-0,2.64=2,8\left(g\right)\)
Ta có hệ phương trình:
\(\left\{{}\begin{matrix}24x+56y=9,2-2,8=6,4\\x+y=0,2\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,15\\y=0,05\end{matrix}\right.\)
a. Trong X có:
\(\left\{{}\begin{matrix}m_{Mg}=24.0,15=3,6\left(g\right)\\m_{Fe}=56.0,05+2,8=5,6\left(g\right)\end{matrix}\right.\)
b
Y: \(\left\{{}\begin{matrix}n_{MgSO_4}=x=0,15\left(mol\right)\\n_{FeSO_4}=y=0,05\left(mol\right)\end{matrix}\right.\)
\(MgSO_4+2NaOH\rightarrow Mg\left(OH\right)_2+Na_2SO_4\)
0,15--------------------->0,15
\(FeSO_4+2NaOH\rightarrow Fe\left(OH\right)_2+Na_2SO_4\)
0,05-------------------->0,05
\(m_{kt}=m_{Mg\left(OH\right)_2}+m_{Fe\left(OH\right)_2}=0,15.58+0,05.90=13,2\left(g\right)\)

a) Vì: mA < 400 (g) nên phải có khí thoát ra → muối có dạng MHSO4 và khí là: CO2
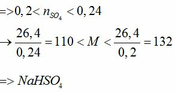
b)
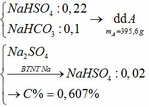
c) Tác dụng được với: MgCO3, Ba(HSO3)2, Al2O3, Fe(OH)2, Fe, Fe(NO3)2
Pt: 2NaHSO4 + MgCO3 → Na2SO4 + MgSO4 + CO2↑ + H2O
2NaHSO4 + Ba(HSO3)2 → BaSO4 + Na2SO4 + SO2↑ + 2H2O
6NaHSO4 + Al2O3 → 3Na2SO4 + Al2(SO4)3 + 3H2O
2NaHSO4 + Fe(OH)2 → Na2SO4 + FeSO4 + 2H2O
2NaHSO4 + Fe → Na2SO4 + FeSO4 + H2↑
12NaHSO4 + 9Fe(NO3)2 → 5Fe(NO3)3 + 2Fe2(SO4)3 + 6Na2SO4 + 3NO↑ + 6H2O

– Số mol KMnO4 = 0,2 (mol); số mol KOH = 2 (mol)
– Phương trình phản ứng:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,2 0,5
* Ở điều kiện nhiệt độ thường:
Cl2 + 2KOH → KCl + KClO + H2O
0,5 1,0 0,5 0,5
– Dư 1,0 mol KOH
CM (KCl) = CM (KClO) = 0,5 (M); CM (KOH dư) = 1 (M)
* Ở điều kiện đun nóng trên 700C:
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
0,5 1,0 5/6 1/6
– Dư 1,0 mol KOH
CM (KCl) = 5/6 (M); CM (KClO3) = 1/6 (M); CM (KOH dư) = 1 (M).
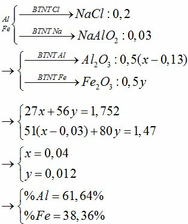



a) 2Al+3FeSO4--->Al2(SO4)3+3Fe
n Al=2,7/27=0,1(mol)
n FeSO4=1.0,2=0,2(mol)
0,1/2 < 0,2/3
--> FeSO4 dư
b) n Fe=3/2n Al=0,15(mol)
m Fe=0,15.56=8,4(g)
c) dd sau pư gồm FeSO4 và Al2(SO4)3
n FeSO4=3/2n Fe=0,15(mol)
n FeSO4 dư=0,2-0,15=0,05(mol)
CM FeSO4=0,05/0,2=0,25(M)
n Al2(SO4)3=1/2n Al=0,05(MOL)
CM Al2(SO4)3=0,05/0,2=0,15(M)
\(n_{Al}=\frac{2,7}{27}=0,1\left(mol\right)\)
\(n_{FeSO4}=1.0,2=0,2\left(mol\right)\)
a.\(PTHH:2Al+3FeSO_4\rightarrow Al_2\left(SO_4\right)_3+3Fe\)
Trước____ 0,1_____0,2_____________
Phản ứng___0,1___0,15_________
Sau____ 0______0,05 _________0,05 _____0,15
Nên Al hết và FeSO4 dư
b. \(m_{Fe}=0,15.56=8,4\left(g\right)\)
c. Dung dịch sau phản ứng gồm Al2(SO4)3 tạo thành và FeSo4 còn dư