Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)Phản ứng sản xuất NH3 là phản ứng tỏa nhiệt, lượng nhiệt tỏa ra dùng để đốt nóng hỗn hợp N2 và H2 cho phản ứng tiếp tục xảy ra
=> Tiết kiệm nhiên liệu đốt cho quá trình phản ứng
b) N2(g) + 3H2(g) → 2NH3(g) ${\Delta _r},H_{298}^0$= -92,22 kJ
Ta có: -92,22 = 2 x ∆fH0298 (NH3) – 1 x ∆fH0298 (N2) - 3 x ∆fH0298 (H2)
=> -92,22 = 2 x ∆fH0298 (NH3) – 0 – 0
=> ∆fH0298 (NH3) = -46,11 kJ

- Xét X là F:
CH4(g) + F2(g) → CH3F(g) + HF(g)
∆rH0298 = 1 x Eb (CH4) + 1 x Eb (F2) - 1 x Eb (HF) - x Eb (CH3F)
∆rH0298 = 1 x 4EC-H + 1 x EF-F - 1 x EH-F - 1 x (3EC-H + EC-F)
∆rH0298 = 1x4 x414 + 1x159– 1x565 - 1x(3x414 + 1x485)= -477kJ
- Xét X là Cl:
CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g)
∆rH0298 = 1 x Eb (CH4) + 1 x Eb (Cl2) - 1 x Eb (HCl) - x Eb (CH3Cl)
∆rH0298 = 1 x 4EC-H + 1 x ECl-Cl - 1 x EH-Cl - 1 x (3EC-H + EC-Cl)
∆rH0298 = 1x4 x414 + 1x243– 1x431 - 1 x(3x414 + 1x339)= -113kJ
- Xét X là Br:
CH4(g) + Br2(g) → CH3Br(g) + HBr(g)
∆rH0298 = 1 x Eb (CH4) + 1 x Eb (Br2) - 1 x Eb (HBr) - x Eb (CH3Br)
∆rH0298 = 1 x 4EC-H + 1 x EBr-Br - 1 x EH-Br - 1 x (3EC-H + EC-Br)
∆rH0298 = 1x4 x414 + 1x193– 1x364 - 1 x(3x414 + 1x276)= -33kJ
- Xét X là I:
CH4(g) + I2(g) → CH3I(g) + HI(g)
∆rH0298 = 1 x Eb (CH4) + 1 x Eb (I2) - 1 x Eb (HI) - x Eb (CH3I)
∆rH0298 = 1 x 4EC-H + 1 x EI-I - 1 x EH-I - 1 x (3EC-H + EC-I)
∆rH0298 = 1x4 x414 + 1x151– 1x297 - 1 x(3x414 + 1x240)= 28kJ
=> Từ F đến I, tính phi kim giảm dần nên khả năng tham gia phản ứng giảm dần
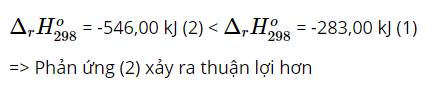
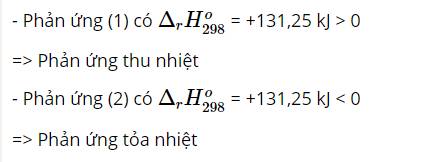


a) Phản ứng này không thuận lợi vì ${\Delta _r},H_{298}^0$ > 0 (phản ứng thu nhiệt)
b) Để phân hủy thạch cao, cần một lượng nhiệt rất lớn và thạch cao sẽ thu hết nhiệt
=> Dùng làm vật liệu tản nhiệt, chống cháy