Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(pH=14+log\left[OH^-\right]=10\)
\(\Rightarrow\left[OH^-\right]=10^{-4}\)
\(n_{NaOH}=10^{-4}\cdot0.3=3\cdot10^{-5}\left(mol\right)\)
\(m_{NaOH}=3\cdot10^{-5}\cdot40=1.2\cdot10^{-3}\left(g\right)\)

Đáp án B
[OH-]= 10-3 (M), nOH-= 0,25.10-3=2,5.10-4 (mol)
Ba(OH)2 → Ba2+ + 2OH-
1,25.10-4 mol 2,5.10-4 mol
mBa(OH)2= 1,25.10-4.171=0,021375 gam

pH=12 => 14 + log[OH-]=12
<=>[OH-]=0,01
=> nNaOH=nOH- = 0,5. 0,01= 0,005(mol)
=> mNaOH=0,005.40=0,2(g)
=> CHỌN D
Chúc em học tốt!

pH=10
=>pOH=4
=>[OH]=10^-4
=>[NaOH]=10^-4 M
=>nNaOH=3*10^-5
=>mNaOH=0,00069g

Ta có: \(pH=14+log\left(OH^-\right)\) \(\Rightarrow log\left(OH^-\right)=-4\)
\(\Rightarrow\left[OH^-\right]=C_{M_{NaOH}}=0,0001\left(M\right)\)
\(\Rightarrow n_{NaOH}=0,0001\cdot0,25=2,5\cdot10^{-5}\left(mol\right)\)
\(\Rightarrow m_{NaOH}=2,5\cdot10^{-5}\cdot40=0,001\left(g\right)\)

Giải thích các bước giải:
pH = 9 → [H+] = 10−9(M)
[H+].[OH-]=10−14
→ [OH-] = 10−5(M)
→ nOH- = 10−5 . 1 = 10−5(mol)
pH=8 → [H+] = 10−8(M)
[H+].[OH-]=10−14
→ [OH-] = 10−6(M)
Gọi x lít là thể tích nước cần dùng
Ta có
\(\dfrac{10^{-5}}{x+1}\)= 10-6
→x=9
Chọn câu C.9 lít

Khi pH = 10 thì [H+] = 1.10-10M và
nghĩa là cần có 1. 10 - 4 mol NaOH trong 1 lít dung dịch.
Vậy trong 250 ml (0,25 lít) dung dịch cần có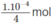 NaOH hoà tan, nghĩa là cần có
NaOH hoà tan, nghĩa là cần có