Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
[OH-]= 10-3 (M), nOH-= 0,25.10-3=2,5.10-4 (mol)
Ba(OH)2 → Ba2+ + 2OH-
1,25.10-4 mol 2,5.10-4 mol
mBa(OH)2= 1,25.10-4.171=0,021375 gam

Khi pH = 10 thì [H+] = 1.10-10M và
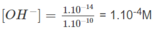
nghĩa là cần có 1. 10 - 4 mol NaOH trong 1 lít dung dịch.
Vậy trong 250 ml (0,25 lít) dung dịch cần có 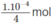 NaOH hoà tan, nghĩa là cần có
NaOH hoà tan, nghĩa là cần có
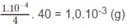 NaOH
NaOH

\(pH=14+log\left[OH^-\right]=10\)
\(\Rightarrow\left[OH^-\right]=10^{-4}\)
\(n_{NaOH}=10^{-4}\cdot0.3=3\cdot10^{-5}\left(mol\right)\)
\(m_{NaOH}=3\cdot10^{-5}\cdot40=1.2\cdot10^{-3}\left(g\right)\)


Đáp án D
Gọi thể tích dung dịch NaOH ban đầu là V
Gọi thể tích dung dịch NaOH sau khi pha là V1
Ta có số mol NaOH ko đổi nên
V.10-3 = V1. 10-5 suy ra V1 = 100V tức là pha loãng 100 lần

Gọi V, V’ lần lượt là thể tích dung dịch NaOH có pH = 12, pH = 11
Do pH = 12 → pOH = 2 → [OH-] = 10-2M → nOH-trước khi pha loãng = 10-2V
pH = 11 → pOH = 3 → [OH-] = 10-3M → nOH-sau khi pha loãng = 10-3V’
Ta có nOH-trước khi pha loãng = nOH-sau khi pha loãng → 10-2V = 10-3V’ → V ' V = 10 - 2 10 - 3 = 10
Vậy cần pha loãng dung dịch NaOH 10 lần
Đáp án A

Gọi V, V’ lần lượt là thể tích dung dịch NaOH có pH = 12, pH = 11
Do pH = 12 => pOH = 2 => [OH-] = 10-2M => nOH-trước khi pha loãng = 10-2V
pH = 11 => pOH = 3 => [OH-] = 10-3M => nOH-sau khi pha loãng = 10-3V’
Ta có nOH-trước khi pha loãng = nOH-sau khi pha loãng 10-2V = 10-3V’ => V ' V = 10 - 2 10 - 3 = 10
Vậy cần pha loãng dung dịch NaOH 10 lần
Chọn A.