Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cái này thì mình giải thích đơn giản là có nghĩa ví dụ đề cho nO2=0.3mol. Nhưng khi ta tính theo phương thì nO2=0.1mol.Từ đây ta suy ra được là O2 dư .Bạn cứ làm nếu thấy nO2 pứng nhỏ hơn nO2 đề thì nó dư thôi. Nếu ko hiểu nữa thì inbox riêng cho mình nha .facebook Lê Đoàn Hương Giang .mình 2k7 nha

a) Phương trình phản ứng:
2CO + O2 → 2CO2
b) Theo phương trình 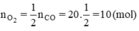
c) Hoàn chỉnh bảng
Thời điểm t1 nCO còn 15mol ⇒ nCO đã phản ứng = 20 - 15= 5mol
Theo pt nCO2 = nCO(pư) = 5 mol
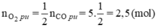 ⇒ nO2 còn lại = 10 - 2,5 = 7,5 mol
⇒ nO2 còn lại = 10 - 2,5 = 7,5 mol
Tương tự tính thời điểm t2 và thời điểm t3 ta được số liệu sau:
| Số mol | |||
| Các thời điểm | Các chất phản ứng | Sản phẩm | |
| CO | O2 | CO2 | |
| Thời điểm ban đầu t0 | 20 | 10 | 0 |
| Thời điểm t1 | 15 | 7,5 | 5 |
| Thời điểm t2 | 3 | 1,5 | 17 |
| Thời điểm kết thúc t3 | 0 | 0 | 20 |

\(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ ĐLBTKL:m_{tg}=m_{sp}=m_X+m_{O_2}=m_{CO_2}+m_{H_2O}=9+0,3.32=18,6\left(g\right)\\ n_{CO_2}:n_{H_2O}=1:1\Rightarrow n_{CO_2}=n_{H_2O}\\ Đặt:n_{CO_2}=n_{H_2O}=t\left(mol\right)\left(t>0\right)\\ \Rightarrow44t+18t=18,6\\ \Leftrightarrow t=0,3\left(mol\right)\\ \Rightarrow n_C=n_{CO_2}=0,3\left(mol\right);n_H=2.0,3=0,6\left(mol\right)\\ Trong.X:m_C=0,3.12=3,6\left(g\right);m_H=0,6.1=0,6\left(g\right)\\ Vì:m_C+m_H=3,6+0,6=4,2< 9\\ \Rightarrow X.chắc.chắn.có.O\\ \Rightarrow X.có:C,H,O\\ m_O=9-4,2=4,8\left(g\right)\\ n_O=\dfrac{4,8}{16}=0,3\left(mol\right)\)
\(b,Đặt.CTĐGN:C_iH_dO_q\left(i,d,q:nguyên,dương\right)\\ Ta.có:i:d:q=0,3:0,6:0,3=1:2:1\\ \Rightarrow CTĐGN:CH_2O\\ c,Ta.có:9< d_{\dfrac{X}{He}}< 21\\ \Leftrightarrow9< \dfrac{M_X}{4}< 21\\ \Leftrightarrow36< M_X< 84\\ Đặt.CTTQ:\left(CH_2O\right)_a\left(a:nguyên,dương\right)\\ \Leftrightarrow36< 30a< 84\\ \Leftrightarrow1,2< a< 2,8\\ \Rightarrow a=2\\ \Rightarrow CTPT:C_2H_4O_2\)
Chúc em học tốt!

\(n_{O_2}=\dfrac{89.6}{22.4}=4\left(mol\right)\)
\(n_{H_2O}=3a\left(mol\right)\)
\(n_{CO_2}=a\left(mol\right)\)
\(2H_2+O_2\underrightarrow{^{^{t^0}}}2H_2O\)
\(2CO+O_2\underrightarrow{^{^{t^0}}}2CO_2\)
\(n_{O_2}=1.5a+0.5a=4\left(mol\right)\)
\(\Leftrightarrow a=2\)
\(n_{H_2}=3\left(mol\right),n_{CO}=1\left(mol\right)\)
\(\%V_{H_2}=\dfrac{3}{4}\cdot100\%=75\%\)
\(\%V_{CO}=25\%\)
\(\%m_{H_2}=\dfrac{3\cdot2}{3\cdot2+1\cdot28}\cdot100\%=17.64\%\)
\(\%m_{CO}=100-17.64=82.36\%\)

nHCl=0,6 mol
FeO+2HCl-->FeCl2+ H2O
x mol x mol
Fe2O3+6HCl-->2FeCl3+3H2O
x mol 2x mol
72x+160x=11,6 =>x=0,05 mol
A/ CFeCl2=0,05/0,3=1/6 M
CFeCl3=0,1/0,3=1/3 M
CHCl du=(0,6-0,4)/0,3=2/3 M
B/
NaOH+ HCl-->NaCl+H2O
0,2 0,2
2NaOH+FeCl2-->2NaCl+Fe(OH)2
0,1 0,05
3NaOH+FeCl3-->3NaCl+Fe(OH)3
0,3 0,1
nNaOH=0,6
CNaOH=0,6/1,5=0,4M


Cách 2 :
$n_{C_6H_6} = 0,04(mol) ; n_{O_2} = 0,45(mol)$
Giả sử $C_6H_6$ hết nên ta áp số mol theo số mol của $C_6H_6$
Theo PTHH :
$n_{O_2\ pư} = \dfrac{15}{2}n_{C_6H_6} = 0,3 < 0,45$
Do đó giả sử đúng.
Suy ra : $C_6H_6$ hết, Oxi dư
hnamyuh Anh ơi vậy bài này có thể dùng cách là so sánh số mol phản ứng và số mol ban đầu ạ