Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đổi 300ml = 0,3 lít
Ta có: \(n_{H_2SO_4}=5.0,3=1,5\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=\dfrac{\dfrac{8\%.400}{100\%}}{171}=\dfrac{32}{171}\left(mol\right)\)
a. PTHH: \(Ba\left(OH\right)_2+H_2SO_4--->BaSO_4\downarrow+2H_2O\)
Ta thấy: \(\dfrac{1,5}{1}>\dfrac{\dfrac{32}{171}}{1}\)
Vậy Ba(OH)2 dư, H2SO4 hết.
Theo PT: \(n_{BaSO_4}=n_{H_2SO_4}=1,5\left(mol\right)\)
\(\Rightarrow m_{BaSO_4}=1,5.233=349,5\left(g\right)\)
b. Không có muối tạo thành

\(nSO_2=0,005mol\)
\(nKOH=0,07\)
Ta thấy \(\dfrac{nKOH}{nSO_2}=14\rightarrow\) tạo muối \(K_2SO_3\) và \(KOH\) dư
\(2KOH+SO_2\rightarrow K_2SO_3+H_2O\)
\(0,01.........0,005\)
\(nK_2SO_3=0,005\rightarrow m=0,79\)

Gọi công thức oxit của kim loại hóa trị III là A2O3,ta có các phương trình sau
A2O3+3H2SO4--->A2(SO4)3+3H2O (1)
0,02<--0,06<---------0,02
Vì sau phản ứng (1) dung dịch còn có thể phản ứng với CaCO3 giải phóng khí CO2=>axit H2SO4 dư,ta có phương trình
H2SO4+CaCO3--->CaSO4+CO2+H2O (2)
0,01<-----0,01--------0,01<-----0,01
nCO2=0,224:22,4=0,01 mol
Khối lượng muối A2(SO4)3 sau khi cô cạn là
9,36-0,01x(40+96)=8 g
Ta thấy rằng A2O3=3,2 g,sau phản ứng tạo thành muối A2(SO4)3=8g Như vậy khối lượng tăng thêm là do 3 gốc -SO4 thay thế cho 3 nguyên tử Oxi,vậy khối lượng tăng thêm là 8-3,2 =4,8 g
nA2SO4=4,8:(96x3-16x3)=0,02 mol
=>khối lượng muối=0,02x(2xR+96x3)=8
=>R=56
R hóa trị III, có M=56=>R là Fe,công thức oxit là Fe2O3
nH2SO4=0,01+0,06=0,07 mol
mH2SO4=0,07x98=6,86g
Bạn ơi bài này đâu cho hóa trị . Họ cho hoát trị n mà.

1.1. Al + NaOH + H2O ==> NaAlO2 + 3/2H2
nH2(1)=3,36/22,4=0.15(mol)
=> nAl(1)= nH2(1):3/2= 0.15:3/2= 0.1(mol)
2.Mg + 2HCl ==> MgCl2 + H2
3.2Al + 6HCl ==> 2AlCl3 + 3H2
4.Fe + 2HCl ==> FeCl2 + H2
=> \(n_{H_2\left(2,3,4\right)}=\) 10.08/22.4= 0.45(mol)
=> nH2(3)=0.1*3/2=0.15(mol)
MgCl2 + 2NaOH ==> Mg(OH)2 + 2NaCl
AlCl3 + 3NaOH ==> Al(OH)3 + 3NaCl
FeCl2 + 2NaOH ==> Fe(OH)2 + 2NaCl

nCO2=0.448:22.4=0.02(mol)
PTHH:CaCO3+2HCl->CaCl2+CO2+H2O
Theo pthh:nHCl=2nCO2->nHCl=0.02*2=0.04(mol)
CM của axit:0.04:0.2=0.2(M)
câu b phải có khối lượng riêng của dd HCl mới tính được chứ bạn?Chứ như vậy không tìm ra được mdd HCl đâu?
xin lỗi bạn....câu a mình ghi thiếu.Chứ thật ra đề yêu cầu tính CM của dd HCl....Thành thật xin lỗi![]()

gọi CTHH kim loại đó là M
=>CTHH của oxit kim loại M2On (n thuộc N*)
M2On+ nH2SO4 loãng =>M2(SO4)n +nH2O (1)
do khi cho CaCO3 vào hỗn hợp sau phản ứng mà có khí CO2 thoát ra nên lượng axit trong phản ứng ban đầu còn dư. và lượng muối sunfat sau khi cô cạn là gồm M2(SO4)n và CaSO4
CaCO3+H2SO4=>CaSO4+H2O+CO2 (2)
theo bài ra:
n CO2 = 0,224/22,4 = 0,01 mol
theo (2): nCaSO4 = n CO2 = 0,01 mol
=> m CaSO4 = 0,01*136 = 1,36 gam
=> m M2(SO4)n = 9,36-1,36 = 8 gam
theo bài ra :
gọi số n M2On là x mol (x>0)
=> n M2(SO4)n = x mol
m M2On = (M*2+16*n)*x = 3,2
m M2(SO4)n = (M*2+96*n)*x = 8
trừ hai vế cho nhau sẽ ra: 112*n*x = 4,8
giả sử n = 1 => x ~ 0,04 => M~32 (loại)
giả sử n = 2 => x ~ 0,02 => M~64(Cu)
tiếp tục giả sử đến n=4 thì vẫn chỉ có mỗi n=2 là phù hợp
=> kim loại M là Cu
=> CT của oxit là CuO
b) viêt lại phương trình:
CuO+H2SO4 => CuSO4+H2O (1)
n H2SO4 (1) = n CuO = 3,2/80 = 0,04 mol
n H2SO4 (2) = n CO2 = 0,01 mol
=> nồng độ mol của dd H2SO4 là:
(0,01+0,04)/0,02 = 2,5 M

\(a,CO_2+Ba(OH)_2\to BaCO_3\downarrow+H_2O\\ b,n_{CO_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ \Rightarrow n_{Ba(OH)_2}=0,1(mol)\\ \Rightarrow C_{M_{Ba(OH)_2}}=\dfrac{0,1}{0,2}=0,5M\\ c,n_{BaCO_3}=0,1(mol)\\ \Rightarrow m_{BaCO_3}=0,1.197=19,7(g)\)
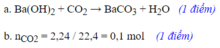
a) CO2+2KOH----->K2CO3+H2O
n CO2=1,68/22,4=0,075(mol)
Theo pthh
n KOH=2n CO2=0,15(mol)
CM KOH=0,15/0,25=0,6(M)
b) CO2+2KOH---->K2CO3+H2O(1)
CO2+KOH--->KHCO3(2)
n CO2=28/22,4=1,25(mol)
m KOH=300.23/100=69(g)
n KOH=69/56=1,23(mol)
-->1,23/1,25<1
Tạo 1 muối axit -->xảy ra pư 2
Theo pthh
n KHCO3=n KOH=1,23(mol)
m KHCO3=1,23.100=123(g)
m dd sau pư=300+(1,25.80)=400(g)
C% KHCO3=123/400.100%=30,75%
Chúc bạn học tốt
Còn câu c