Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: \(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
\(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_{O_2}=0,15\left(mol\right)\\n_{KMnO_4}=0,3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{O_2}=0,15\cdot22,4=3,36\left(l\right)\\m_{KMnO_4}=0,3\cdot158=47,4\left(g\right)\end{matrix}\right.\)

\(n_{Al}=\dfrac{5.4}{27}=0,2mol\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
0,2 0,15 0,1
a)\(V_{O_2}=0,15\cdot22,4=3,36l\)
b)\(n_{O_2}=0,15\cdot10\%=0,015mol\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
0,03 0,015
\(m_{KMnO_4}=0,03\cdot158=4,74g\)

Có lẽ đề cho "Đốt cháy hoàn toàn 5,4 g Al" bạn nhỉ?
a, PT: \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{3}{4}n_{Al}=0,15\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,15.22,4=3,36\left(l\right)\)
b, PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Theo PT: \(n_{KMnO_4}=2n_{O_2}=0,3\left(mol\right)\)
\(\Rightarrow m_{KMnO_4}=0,3.158=47,4\left(g\right)\)

Em viết thiếu là Oxi phải ghi rõ là ởđktc
nH2=5.4/22.4=0.2 mol
4Al + 3O2 ---> 2Al2O3
0.2 0.15 0.1
a) V=n*22.4=>0.15*22.4=3.36 l
b)2KMnO4 + nhiệt phân -----> K2MnO4 +MnO2+ O2
0.3 0.15
m=n*M=> 0.3*158=47.4g
Bài này ko khó lắm đâu!Cố gắng nhé!
a)4Al+3O2==>2Al2O3 (1)
Theo pthh (1) ta có:
Cứ 4.27 gam Al phản ứng hết thì cần có 3.22,4 lít khí O2
Vậy 5,4 gam Al phản ứng hết thì cần có x lít khí O2
=> x=(5,4.3.22,4):(4.27)=3,36 (L)
b)Ta có: 2KMnO4=>K2MnO4+MnO2+O2 (2)
Theo pthh (1) ta có
Cứ 22,4 lít khí O2 được tạo ra cần 2.158 gam KMnO4
Vậy 3,36 lít khí O2 được tạo ra cần y gam KMnO4
=> y=(3,36.2.158):22,4=47,4 (G)

a.\(n_{Al}=\dfrac{m_{Al}}{M_{Al}}=\dfrac{2,7}{27}=0,1mol\)
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
0,1 0,075 ( mol )
\(V_{O_2}=n_{O_2}.22,4=0,075.22,4=1,68l\)
b.
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,15 0,075 ( mol )
\(m_{KMnO_4}=n_{KMnO_4}.M_{KMnO_4}=0,15.158=23,7g\)

nAl = 5,4/27 = 0,2 (mol)
PTHH: 4Al + 3O2 -> (t°) 2Al2O3
Mol: 0,2 ---> 0,15
VO2 = 0,15 . 22,4 = 3,36 (l)
PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
nKMnO4 = 0,15 . 2 = 0,3 (mol)
mKMnO4 = 0,3 . 158 = 47,4 (g)

\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
0,2 0,15 ( mol )
\(V_{O_2}=0,15.22,4=3,36l\)
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,3 0,15 ( mol )
\(m_{KMnO_4}=0,3.158=47,4g\)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\
pthh:4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
0,2 0,15
\(V_{O_2}=0,15.22,4=3,36l\\
PTHH:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
0,3 0,15
\(m_{KMnO_4}=158.0,3=47,4g\)

nAl=16,2/27= 0,6(mol)
a) PTHH: 4 Al +3 O2 -to-> 2 Al2O3
nO2= 3/4 . nAl=3/4 . 0,6= 0,45(mol)
=> V(O2,đktc)=0,45 x 22,4=10,08(l)
b) nAl2O3= nAl/2=0,6/2=0,3(mol)
=>mAl2O3=102. 0,3= 30,6(g)
c) 2KMnO4 -to-> K2MnO4 + MnO2 + O2
nKMnO4= 2.nO2=2. 0,45=0,9(mol)
=>mKMnO4= 158 x 0,9= 142,2(g)
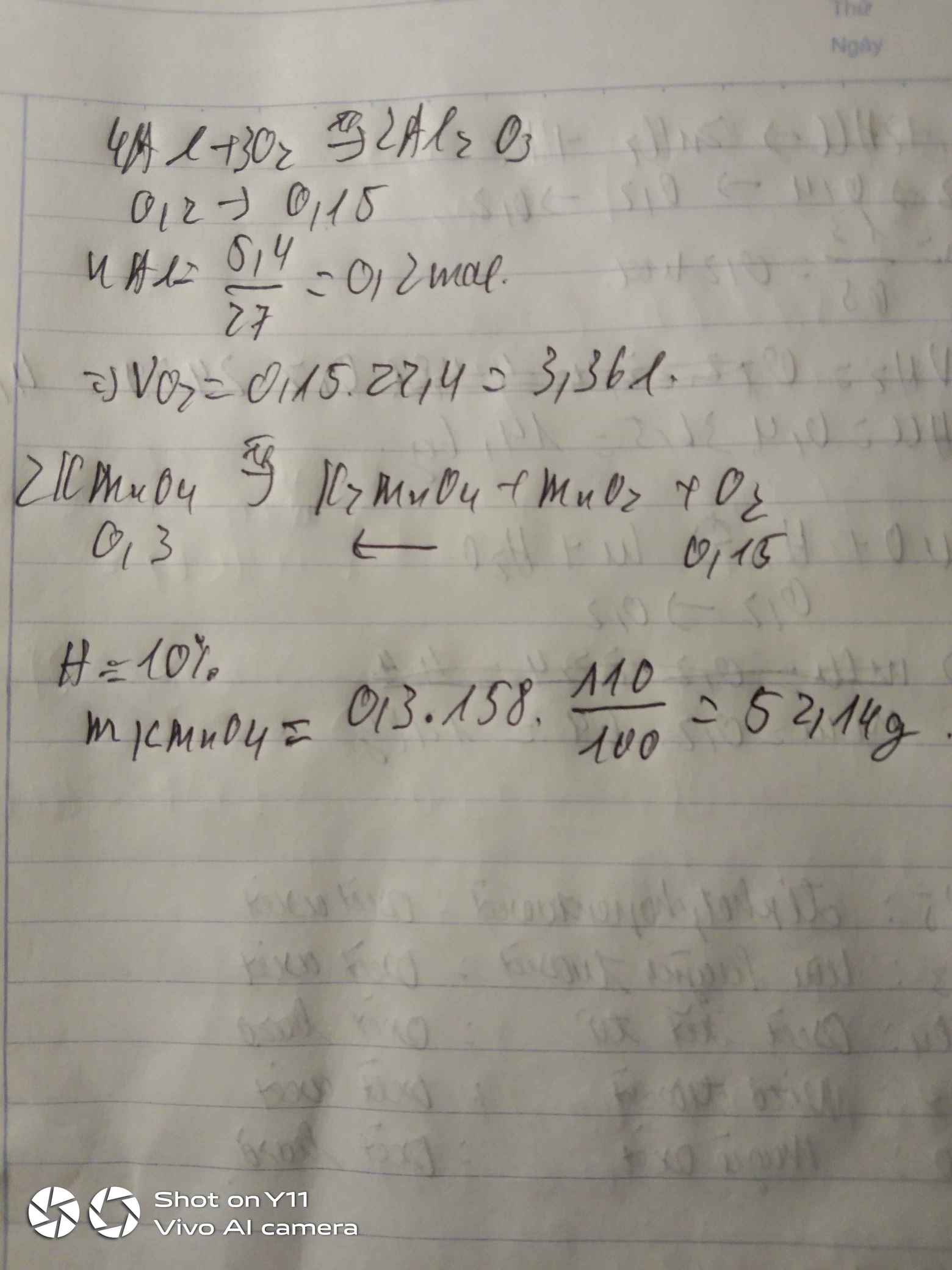
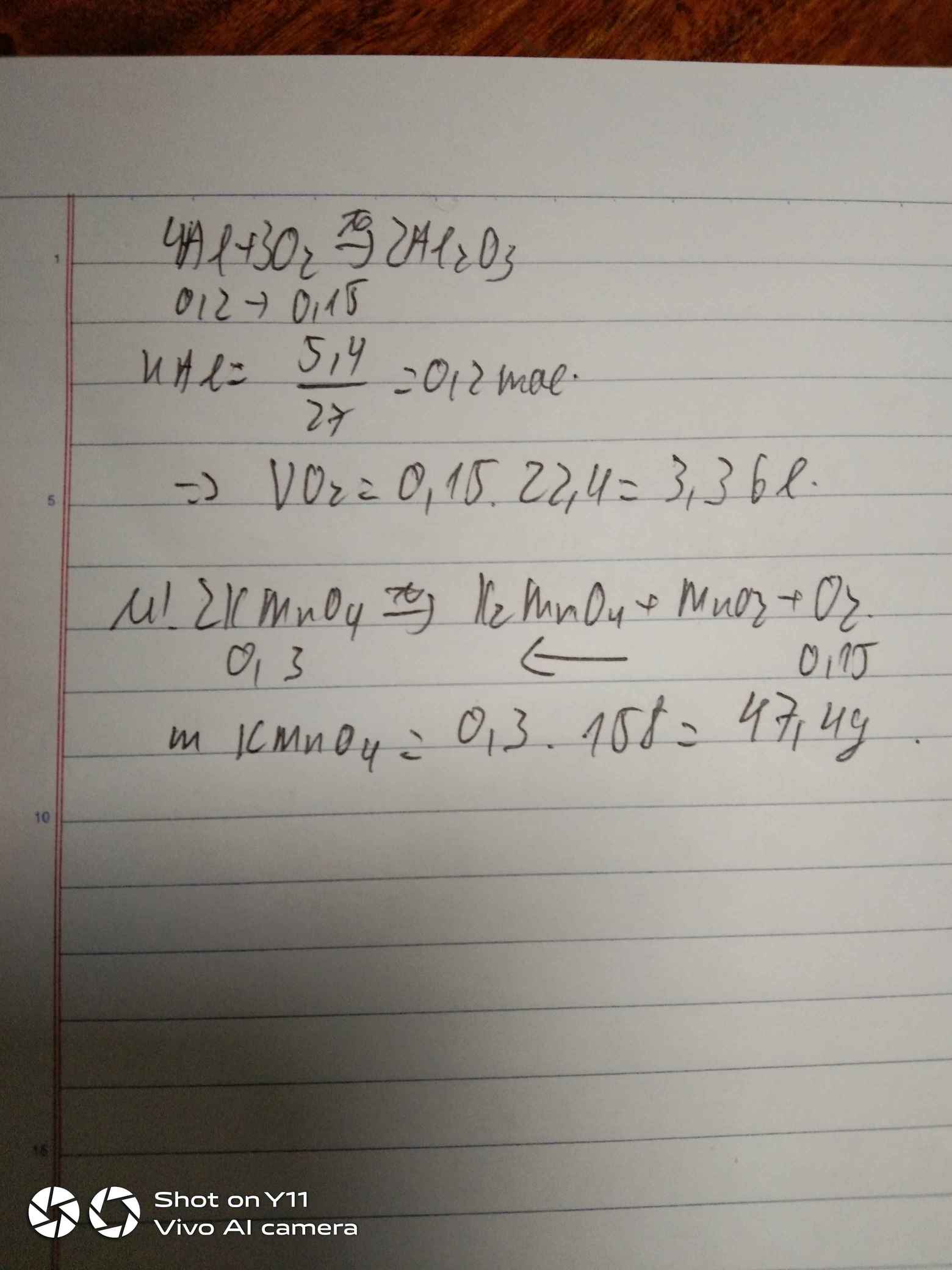

\(n_{Al}=\dfrac{5.4}{27}=0.2\left(mol\right)\)
\(4Al+3O_2\underrightarrow{^{^{t^0}}}2Al_2O_3\)
\(0.2..........0.15\)
\(V_{O_2}=0.15\cdot22.4=3.36\left(l\right)\)
\(2KMnO_4\underrightarrow{^{^{t^0}}}K_2MnO_4+MnO_2+O_2\)
\(0.3...............................................0.15\)
\(m_{KMnO_4}=0.3\cdot158=47.4\left(g\right)\)