
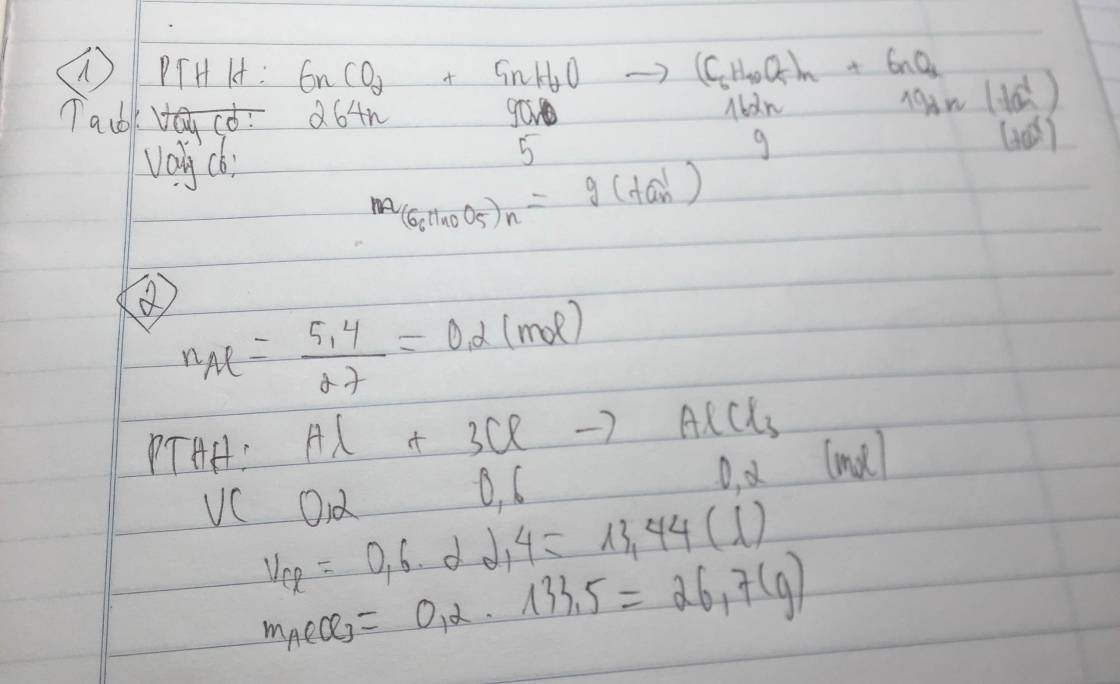
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

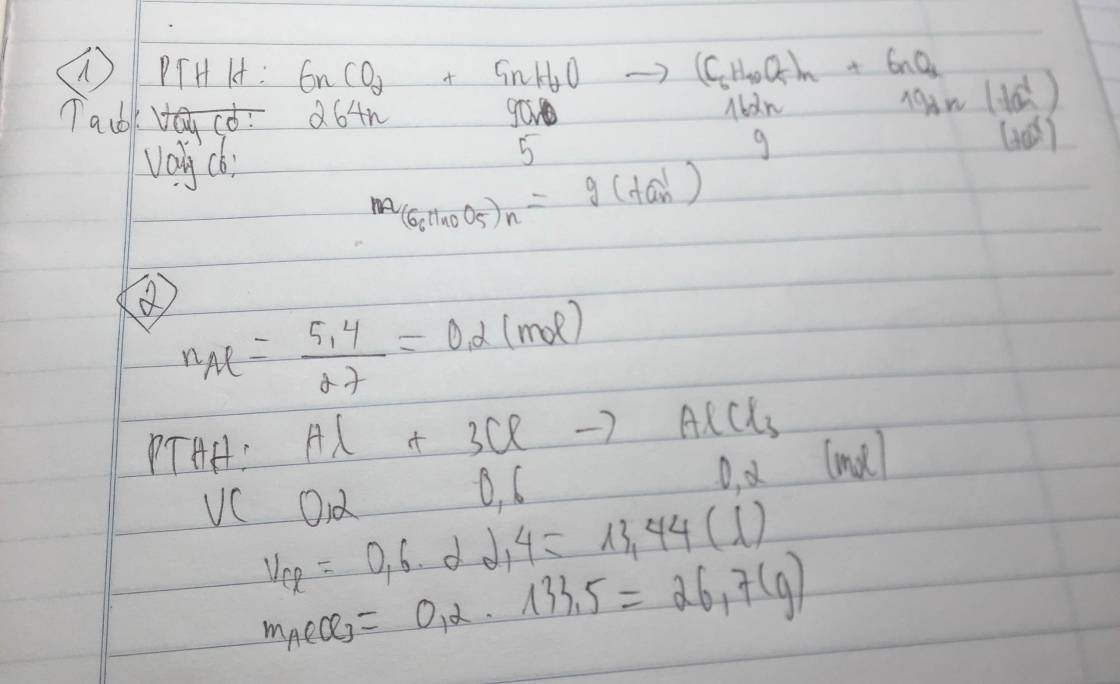

Bài 1:
\(n_{C_4H_{10}}=\frac{m}{M}=\frac{11,6}{58}=0,2mol\)
PTHH: \(2C_4H_{10}+13O_2\rightarrow^{t^o}8CO_2\uparrow+10H_2O\)
0,2 1,3 0,8 1 mol
\(\rightarrow n_{O_2}=n_{C_4H_{10}}=\frac{13.0,2}{2}=1,3mol\)
\(V_{O_2\left(ĐKTC\right)}=n.22,4=1,3.22,4=29,12l\)
\(\rightarrow n_{CO_2}=n_{C_4H_{10}}=\frac{8.0,2}{2}=0,8mol\)
\(m_{CO_2}=n.M=0,8.44=35,2g\)
\(\rightarrow n_{H_2O}=n_{C_4H_{10}}=\frac{10.0,2}{2}=1mol\)
\(m_{H_2O}=n.M=1.18=18g\)

a, nCaCO3=10/100=0,1 mol
PTHH: CaCO3+2HCl---> CaCl2+CO2+H2O
Theo pthh ta có: nCaCl2=nCaCO3=0,1 mol
=> mCaCl2=0,1.111=11,1 (g)
b, nCaCO3=5/100=0,05 mol
Theo pthh ta có : nCO2=nCaCO3=0,05 mol
=> VO2(điều kiện phòng)= 0,05.24= 1,2 l
a) Số mol canxi cacbonat tham gia phản ứng
=
= 0,1 mol
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Theo phương trình hóa học, ta có:
=
= 0,1 mol
Khối lượng của canxi clotua tham gia phản ứng:
= 0,1 . (40 + 71) = 11,1 g
b) Số mol canxi cacbonat tham gia phản ứng:
=
= 0,05 mol
Theo phương trình hóa học, ta có:
=
= 0,05 mol
Thể tích khí CO2 ở điều kiện phòng là:
= 24 . 0,05 = 1,2 lít

Bài 1, H2 + CuO-t0-> H2O + Cu
4Al + 3O2-t0-> 2Al2O3
Fe2O3 + 3H2---t0--> 2Fe + 3H2O
2KClO3--t0--> 2KCl + 3O2
Bài 2, a, Zn + 2HCl--> ZnCl2 + H2
Ta có nZn=13/65=0,2 mol=nH2=nZnCl2
=> mZnCl2=0,2.136=27,2 g
b, Ta có VH2=0,2.22,4=4,48 lít
Bài 1:
1) H2 + CuO \(\underrightarrow{to}\) Cu + H2O
Tỉ lệ: 1 : 1 : 1 : 1
2) 4Al + 3O2 \(\underrightarrow{to}\) 2Al2O3
Tỉ lệ: 4 : 3 : 2
3) Fe2O3 + 3H2 \(\underrightarrow{to}\) 2Fe + 3H2O
Tỉ lệ: 1 : 3 : 2 : 3
4) 2KClO3 \(\underrightarrow{to}\) 2KCl + 3O2
Tỉ lệ: 2 : 2 : 3

a) Na2O + H2O → 2NaOH
K2O + H2O → 2KOH
b) SO2 + H2O → H2SO3
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3
c) NaOH + HCl → NaCl + H2O
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + H2O
d) Loại chất tạo ra ở câu a gồm NaOH, KOH là bazơ kiềm; loại chất tạo ra ở câu b gồm H2SO3, H2SO4,H2SO4 là axit, loại chất tạo ra ở câu c gồm NaCl, Al2(SO4)3 là muối.
Sự khác nhau giữa câu a và câu b là oxit của kim loại Na2O, K2O tác dụng với nước tạo thành bazơ, còn oxit của phi kim SO2, SO3, N2O5 tác dụng với nước tạo thành axit.
a) Na2O + H2O → 2NaOH
K2O + H2O → 2KOH
b) SO2 + H2O → H2SO3
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3
c) NaOH + HCl → NaCl + H2O
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + H2O
d) Loại chất tạo ra ở câu a gồm NaOH, KOH là bazơ kiềm; loại chất tạo ra ở câu b gồm H2SO3, H2SO4,H2SO4 là axit, loại chất tạo ra ở câu c gồm NaCl, Al2(SO4)3 là muối.Sự khác nhau giữa câu a và câu b là oxit của kim loại Na2O, K2O tác dụng với nước tạo thành bazơ, còn oxit của phi kim SO2, SO3, N2O5 tác dụng với nước tạo thành axit

CaCO3 + 2HCl -> CaCl2 + CO2 + H2O (1)
2NaOH + CO2 -> Na2CO3 + H2O (2)
nCaCO3=0,15(mol)
nHCl=0,2(mol)
Vì \(\dfrac{0,2}{2}< 0,15\) nên CaCO3 dư
Theo PTHH 1 ta có:
nCO2=\(\dfrac{1}{2}\)nHCl=0,1(mol)
Theo PTHH 2 ta có:
nCO2=nNa2CO3=0,1(mol)
mNa2CO3=106.0,1=10,6(g)

Bài 1:
1) H2 + CuO \(\underrightarrow{to}\) Cu + H2O
Tỉ lệ: 1 : 1 : 1 : 1
2) 4Al + 3O2 \(\underrightarrow{to}\) 2Al2O3
Tỉ lệ: 4 : 3 : 2
3) Fe2O3 + 3H2 \(\underrightarrow{to}\) 2Fe + 3H2O
Tỉ lệ: 1 : 3 : 2 : 3
4) 2KClO3 \(\underrightarrow{to}\) 2KCl + 3O2
Tỉ lệ: 2 : 2 : 3
Bài 2:
Zn + 2HCl → ZnCl2 + H2
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
a) Theo PT: \(n_{ZnCl_2}=n_{Zn}=0,2\left(mol\right)\)
\(\Rightarrow m_{ZnCl_2}=0,2\times136=27,2\left(g\right)\)
b) Theo pT: \(n_{H_2}=n_{Zn}=0,2\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,2\times22,4=4,48\left(l\right)\)