Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C.
Kim loại không phản ứng với H2SO4 loãng là Cu.
Gọi nCu = x, nMg = y, nAl = z
Ta có:
64x + 24y + 27z = 33,2 (1)
Bảo toàn e:
2nMg + 3nAl = 2nH2
=> 2y + 3z = 2.1 (2)
2nCu = 2nSO2 => x = 0.2 (mol) (3)
Từ 1, 2, 3 => x = 0,2; y = z = 0,4 (mol)
mCu = 0,2.64 = 12,8 (g)
mMg = 0,4.24 = 9,6 (g)
mAl = 10,8 (g)

Bài 3 :
a) $Mg + H_2SO_4 \to MgSO_4 + H_2$
$n_{Mg} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$\%m_{Mg} = \dfrac{0,15.24}{13,2}.100\% = 27,27\%$
$\%m_{Cu} = 100\% -27,27\% = 72,73\%$
b) $n_{Cu} = \dfrac{13,2 - 0,15.24}{64}= 0,15(mol)$
$\Rightarrow m_{muối} = 0,15.120 + 0,15.160= 42(gam)$
Bài 4 :
Gọi $n_{Fe} = a(mol) ; n_{Mg} = b(mol)$
$56a + 24b = 18,4(1)$
$Fe + 2HCl \to FeCl_2 + H_2$
$Mg + 2HCl \to MgCl_2 + H_2$
Theo PTHH : $n_{H_2} = a + b = \dfrac{11,2}{22,4} = 0,5(2)$
Từ (1)(2) suy ra a = 0,2 ; b = 0,3
$\%m_{Fe} = \dfrac{0,2.56}{18,4}.100\% = 60,87\%$
$\%m_{Mg} = 100\% -60,87\% = 39,13\%$
b) $n_{HCl} = 2n_{H_2} = 1(mol)$
$V_{dd\ HCl} = \dfrac{1}{0,8}= 1,25(lít)$

Đáp án D
Số mol H2 thu được là : n H 2 = 11 , 2 22 , 4 = 0 , 5 mol
Gọi M là kim loại chung cho Al và Mg với hóa trị n
Sơ dồ phản ứng :
M ⏟ 10 , 2 gam + H 2 S O 4 ( l o ã n g , d ư ) → M 2 ( S O 4 ) n ⏟ m u ố i + H 2 ↑ ⏟ 0 , 5 m o l
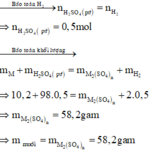

Khối lượng kim loại trong hỗn hợp:
- Số mol H 2 ở (1) và (2) n H 2 = 8,96/22,4 = 0,4 mol
- Đặt x và y là số mol Mg và Al có trong hỗn hợp. Từ (1) và (2) ta có hệ phương trình đại số :
x + 3/2y = 0,4
24x + 27y = 7,8
Giải hệ phương trình, ta được x = 0,1 và y = 0,2.
Khối lượng các kim loại :
m Mg = 0,1 x 24 = 2,4g
m Al = 0,2 x 27 = 5,4g

a)\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Mol: x 1,5x
PTHH: Mg + H2SO4 → MgSO4 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}27x+24y=5,1\\1,5x+y=0,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{0,1.27.100\%}{5,1}=52,94\%;\%m_{Mg}=100-52,94=47,06\%\)
b)
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Mol: 0,1 0,15 0,05
PTHH: Mg + H2SO4 → MgSO4 + H2
Mol: 0,1 0,1 0,1
\(m_{ddH_2SO_4}=\dfrac{\left(0,1+0,15\right).98.100}{9,8}=250\left(g\right)\)
mdd sau pứ = 5,1+250-0,15.2 = 254,8(g)
\(C\%_{ddAl_2\left(SO_4\right)_3}=\dfrac{0,05.342.100\%}{254,8}=6,71\%\)
\(C\%_{ddMgSO_4}=\dfrac{0,1.120.100\%}{254,8}=4,71\%\)

Sửa đề: 6,4 gam hh \(\rightarrow\) 6,45 gam hh
a) Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow24a+27b=6,45\) (1)
Ta có: \(n_{H_2}=\dfrac{7,28}{22,4}=0,325\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,65\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=n_{Mg}=0,1\left(mol\right)\\b=n_{Al}=0,15\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,1\cdot24}{6,4}\cdot100\%=37,5\%\\\%m_{Mg}=62,5\%\end{matrix}\right.\)
b) Ta thấy với 6,45 gam hh thì có 0,1 mol Mg và 0,15 mol Al
\(\Rightarrow\) Trong 12,9 gam hh thì chứa 0,2 mol Mg và 0,3 mol Al
Gọi \(n_{SO_2}=x\left(mol\right)\)
Bảo toàn electron: \(2\cdot0,2+3\cdot0,3=2x\) \(\Rightarrow x=n_{SO_2}=0,65\left(mol\right)\)
\(\Rightarrow V_{SO_2}=0,65\cdot22,4=14,56\left(l\right)\)
gọi số mol của Mg là x mol ; Al là y mol => 24x + 27y =6,4
n khí = 7,28/22,4=0,325 mol
bảo toàn e ta có
Mg + H2SO4 --> MgSO4 + H2
x x mol
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
y 3/2 y mol
=> x + 3/2y=0,325
=> x=11/120 mol ; y=7/45 mol
=> mMg11/120*24=2,2g => %mMg = 2,2*100/6,4=34,375%
=>%mAl=100-34,375=65,625%

a)
$Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + H_2O$
$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$
b) n Cu =a (mol) ; n Fe = b(mol)
=> 64a + 56b = 12(1)
n SO2 = a + 1,5b = 5,6/22,4 = 0,25(2)
(1)(2) suy ra a = b = 0,1
%m Cu = 0,1.64/12 .100% = 53,33%
%m Fe = 100% -53,33% = 46,67%
c)
n CuSO4 = a = 0,1(mol)
n Fe2(SO4)3 = 0,5a = 0,05(mol)
m muối = 0,1.160 + 0,05.400 = 36(gam)
d) n H2SO4 = 2n SO2 = 0,5(mol)
V H2SO4 = 0,5/2 = 0,25(lít)

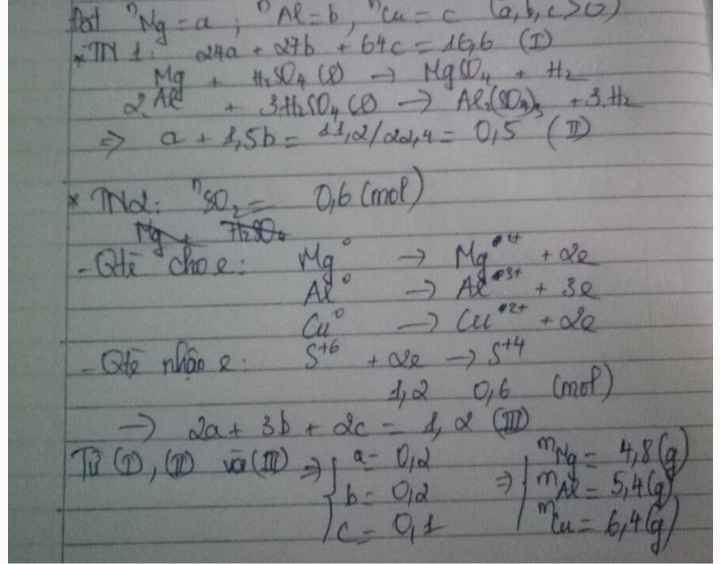
Gọi $n_{Mg} = a ; n_{Al} = b ; n_{Cu} = c$
$\Rightarrow 24a + 27b + 64c = 16,6(1)$
Thí nghiệm 1 :
$Mg + H_2SO_4 \to MgSO_4 + H_2$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
$\Rightarrow n_{H_2} = a + 1,5b = \dfrac{11,2}{22,4} = 0,5(2)$
Thí nghiệm 2 : $n_{SO_2} = \dfrac{13,44}{22,4} = 0,6(mol)$
Bảo toàn electron :
$2a + 3b + 2c = 0,6.2(3)$
Từ (1)(2)(3) suy ra a = 0,2 ; b = 0,2 ; c = 0,1
$m_{Mg} = 0,2.24 = 4,8(gam)$
$m_{Al} = 0,2.27 = 5,4(gam)$
$m_{Cu} = 0,1.64 = 6,4(gam)$