Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
b, \(n_{Fe_2O_3}=\dfrac{2,32}{232}=0,01\left(mol\right)\)
Theo PT: \(n_{O_2}=2n_{Fe_2O_3}=0,02\left(mol\right)\Rightarrow V_{O_2}=0,02.22,4=0,448\left(l\right)\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
\(2mol\) \(1mol\)
\(0,02mol\) \(0,01mol\)
\(n_{Fe_3O_4}=\dfrac{m}{M}=\dfrac{2,32}{232}=0,01\left(mol\right)\)
\(V_{O_2}=n.22,4=0,02.22,4=0,048\left(l\right)\)

a) Phương trình hóa học của phản ứng:
3Fe + 2O2 → Fe3O4.
nFe3O4 = 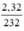 = 0,01 mol.
= 0,01 mol.
nFe = 3.nFe3O4 = 0,01 .3 = 0,03 mol.
nO2 = 2.nFe3O4 = 0,01 .2 = 0,02 mol.
mFe = 0,03.56 = 1,68g.
mO2 = 0,02.32 = 0,64g.
b) Phương trình phản ứng nhiệt phân KMnO4:
2KMnO4 → K2MnO4 + MnO2 + O2
nKMnO4 = 2.nO2 = 0,02.2 = 0,04 mol.
mKMnO4 = 0,04 .158 = 6,32g.

a) Phương trình hóa học của phản ứng:
3Fe + 2O\(_2\) → Fe\(_3\)O\(_4\).
nFe3O4 = \(\dfrac{2,32}{232}\) = 0,01 mol.
nFe = 3.nFe3O4 = 0,01 .3 = 0,03 mol.
nO2 = 2.nFe3O4 = 0,01 .2 = 0,02 mol.
mFe = 0,03.56 = 1,68g.
mO2 = 0,02.32 = 0,64g.
b) Phương trình phản ứng nhiệt phân KMnO4:
2KMnO4 → K2MnO4 + MnO2 + O2
nKMnO4 = 2.nO2 = 0,02.2 = 0,04 mol.
mKMnO4 = 0,04 .158 = 6,32g.
a.
\(n_{Fe_3O_4}=\dfrac{2,32}{232}=0,01mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,03 0,02 0,01 ( mol )
\(m_{Fe}=0,03.56=1,68g\)
\(m_{O_2}=0,02.32=0,64g\)
b.
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,04 0,02 ( mol )
\(m_{KMnO_4}=0,04.158=6,32g\)

3Fe+2O2-to>Fe3O4
0,06----------------0,03
n Fe3O4 =\(\dfrac{6,96}{232}\)=0,03 mol
=>VO2=0,06.22,4=1,344l

\(Mg+S\rightarrow\left(t^o\right)MgS\)
\(Zn+S\rightarrow\left(t^o\right)ZnS\)
\(Fe+S\rightarrow\left(t^o\right)FeS\)
\(2Al+3S\rightarrow\left(t^o\right)Al_2S_3\)

\(n_{Fe_3O_4}=\dfrac{2.32}{232}=0.01\left(mol\right)\)
\(3Fe+2O_2\underrightarrow{^{t^0}}Fe_3O_4\)
\(0.03......0.02.........0.01\)
\(m_{Fe}=0.03\cdot56=1.68\left(g\right)\)
\(m_{O_2}=0.02\cdot32=0.64\left(g\right)\)
\(2KMnO_4\underrightarrow{^{t^0}}K_2MnO_4+MnO_2+O_2\)
\(0.04............................................0.02\)
\(m_{KMnO_4}=0.04\cdot158=6.32\left(g\right)\)
a)
n Fe3O4 = 2,32/232 = 0,01(mol)
3Fe + 2O2 \(\xrightarrow{t^o}\) Fe3O4
0,03....0,02.......0,01...........(mol)
m Fe = 0,03.56 = 1,68(gam)
m O2 = 0,02.32= 0,64(gam)
c)
$2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2$
n KMnO4 = 2n O2 = 0,04(mol)
m KMnO4 = 0,04.158 = 6,32 gam

Phương trình hóa học:
Mg + S → MgS
Fe + S → FeS
Zn + S → ZnS
2Al + 3S → Al2S3

Sửa đề: 4,46 (g) → 4,64 (g)
a, \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
\(n_{Fe_3O_4}=\dfrac{4,64}{232}=0,02\left(mol\right)\)
Theo PT: \(n_{Fe}=3n_{Fe_3O_4}=0,06\left(mol\right)\Rightarrow m_{Fe}=0,06.56=3,36\left(g\right)\)
\(n_{O_2}=2n_{Fe_3O_4}=0,04\left(mol\right)\Rightarrow m_{O_2}=0,04.32=1,28\left(g\right)\)
b, \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
\(n_{KMnO_4}=2n_{O_2}=0,08\left(mol\right)\Rightarrow m_{KMnO_4}=0,08.158=12,64\left(g\right)\)

a,\(n_{Fe_3O_4}=\dfrac{2,32}{232}=0,01\left(mol\right)\)
PTHH: 3Fe + 2O2 --to--> Fe3O4
0,03<--0,02<-------0,01
\(\left\{{}\begin{matrix}m_{Fe}=0,03.56=1,68\left(g\right)\\m_{O_2}=0,02.32=0,64\left(g\right)\end{matrix}\right.\)
b, PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,04<-----------------------------------0,02
\(m_{KMnO_4}=\dfrac{0,04.158}{85\%}=7,435\left(g\right)\)
1
Mg+S−to−>MgS
Zn+S−to−>ZnS
Fe+S−to−>FeS
2Al+3S−to−>Al2S3
2
a. Số mol oxit sắt từ
nFe3O4=2,32\(56.3+16.4) = 0,01 (mol).
Phương trình hóa học.
3Fe + 2O2 -> Fe3O4
3mol ---- 2mol -------------- 1mol.
------------------------------------ 0,01 mol.
Khối lượng sắt cần dùng là : m = 56.3.0,01\1=1,68 (g).
Khối lượng oxi cần dùng là : m = 32.2.0,01\1==0,64 (g).
Bài 1
\(Mg+S-->MgS\)
\(Fe+S-->FeS\)
\(2Al+3S-->Al2S3\)
Bài 2
\(3Fe+2O2-->FE3O4\)
\(n_{Fe3O4}=\frac{2,32}{232}=0,01\left(mol\right)\)
\(n_{Fe}=3n_{Fe3O4}=0,03\left(mol\right)\)
\(m_{Fe}=0,03.56=1,68\left(g\right)\)