Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nSO2 = 3,36/22,4 = 0,15 mol; nNaOH = 0,1 mol.
nOH/nSO2 = 2/3 < 1 ---> chỉ có muối axit.
SO2 + NaOH ----> NaHSO3

\(n_{NaOH}=0,4\left(mol\right)\)
\(n_{SO2}=0,25\left(mol\right)\)
\(T=\frac{OH^-}{SO^{2-}_2}=\frac{0,4}{0,25}=1,6\)
⇒Tạo muối:Na2CO3,NaHCO3
\(2NAOH+CO_2\rightarrow Na_2CO_3+H_2O\)
\(NaOH+CO_2\rightarrow NaHCO_3\)

Ta thấy khi cho Br 2 vào dung dịch 2 muối S 4 + thì toàn bộ S 4 + sẽ bị oxi hoá lên S 6 + ( SO 4 2 - )do đó :
n SO 2 = n SO 4 2 - = 0,15
=> m BaSO 4 = 0,15.233 = 34,95g

a, NaOH + SO2 --> NaHSO3
NaOH + 2SO2 --> Na2SO3 + H2O
b, Gọi nNaHSO3=x, nNa2SO3=y
BTNT Na có nNaHSO3 + 2.nNa2SO3=nNaOH => x + 2y = 0,2
mNaHSO3 + mNa2SO3=16,7 <=> 104x + 126y = 16,7
=>x=0,1 ; y=0,05
BTNT S có: nSO2=nNaHSO3 + nNa2SO3= x+ y=0,1+0,05=0,15
=> V=0,15.22,4=3,36 lit

1) Ptpư:
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
Cu + HCl \(\rightarrow\) không phản ứng
=> 0,6 gam chất rắn còn lại chính là Cu:
Gọi x, y lần lượt là số mol Al, Fe
Ta có:
3x + 2y = 2.0,06 = 0,12
27x + 56 y = 2,25 – 0,6 = 1,65
=> x = 0,03 (mol) ; y = 0,015 (mol)
=> \(\%Cu=\frac{0,6}{2,25}.100\%=26,67\%\); \(\%Fe=\frac{56.0,015}{2,25}.100\%=37,33\%\); %Al = 36%
2) \(n_{SO_2}=\frac{1,344}{22,4}=0,06mol\); m (dd KOH) = 13,95.1,147 = 16 (gam)
=> mKOH = 0,28.16 = 4,48 (gam)=> nKOH = 0,08 (mol)=> \(1<\)\(\frac{n_{KOH}}{n_{SO_2}}<2\)
=> tạo ra hỗn hợp 2 muối: KHSO3: 0,04 (mol) và K2SO3: 0,02 (mol)
Khối lượng dung dịch sau pu = 16 + 0,06.64 = 19,84 gam
=> \(C\%\left(KHSO_3\right)=\frac{0,04.120}{19,84}.100\%\)\(=24,19\%\)
\(C\%\left(K_2SO_3\right)=\frac{0,02.158}{19,84}.100\%\)\(=15,93\%\)

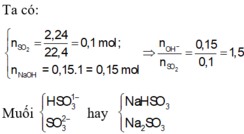
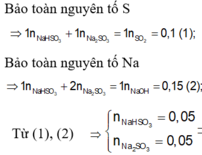

nSO2 = 3.36/22.4 = 0.15 (mol)
nNaOH = 0.5 * 0.1 = 0.05 (mol)
nNaOH / nSO2 = 0.05 / 0.15 = 0.3
Chỉ tạo ra muối axit
NaOH + SO2 => NaHSO3
0.05.........0.05.........0.05
mNaHSO3 = 0.05 * 104 = 5.2 (g)
nSO2= 3,36/22,4=0,15mol
nNaOH=0,5*0,1=0,05 mol
pthh 2NaOH + SO2 --> Na2SO3 + H2O
0,05 0,025 mol
ta thấy nNaOH/2<nSO2/1 =>NaOH hết , SO2 dư
=> m Na2SO3=0,025*126=3,15 g