Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1.
a. \(100kg=10^5g\)
Vì chứa 25% tạp chất
\(\Rightarrow\%m_{FeS_2}=100-25=75\%\)
\(\Rightarrow m_{FeS_2}=10^5.75\%=75000\left(g\right)\)
\(\Rightarrow n_{FeS_2}=\frac{m}{M}=\frac{75000}{120}=625\left(mol\right)\)
\(PTHH:2FeS_2+\frac{11}{2}O_2\underrightarrow{t^o}Fe_2O_3+4SO_2\)
\(PTHH:2SO_2+O_2\underrightarrow{t^o,V_2O_5}2SO_3\)
\(PTHH:SO_3+H_2O\rightarrow H_2SO_4\)
Ta thấy: \(n_{FeS_2}=2n_{SO_2};n_{SO_2}=n_{SO_3};n_{SO_3}=n_{H_2SO_4}\)
\(FeS_2\rightarrow SO_2\rightarrow SO_3\rightarrow H_2SO_4\)
\(\left(mol\right)1\rightarrow2\rightarrow2\rightarrow2\)
\(\left(mol\right)625\rightarrow1250\rightarrow1250\rightarrow1250\)
Ta có: \(H=60\%\Rightarrow n_{H_2SO_4}=1250.60\%=750\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=n.M=750.98=73500\left(g\right)\)
\(m_{ddH_2SO_4}=\frac{73500.100\%}{98\%}=75000\left(g\right)=75\left(kg\right)\)
\(468kg=46800\left(g\right)\)
\(n_{Ca\left(H_2PO_4\right)_2}=\frac{m}{M}=\frac{46800}{234}=200\left(mol\right)\)
\(PTHH:Ca_3\left(PO_4\right)_2+2H_2SO_4\rightarrow Ca\left(H_2PO_4\right)_2+2CaSO_4\downarrow\)
(mol) 1 ___________2_________1____________2
(mol) 200__________400
Vì \(H=80\%\rightarrow n_{H_2SO_4}=400.80\%=320\left(mol\right)\)
\(m_{H_2SO_4}=n.M=320.98=31360\left(g\right)\)
\(m_{ddH_2SO_4}=\frac{31360.100\%}{70\%}=44800\left(g\right)=4,48\left(kg\right)\)

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

Có: nH2SO4 \(=\frac{4,9}{98}=0,05\left(mol\right)\)
Vì: \(x_1+H2S\text{O4}\rightarrow X_2+X_3\) nên X1 có thể là: oxit bazo, oxit lưỡng tính, bazo, hidroxit lưỡng tính, muối. Nhưng vì bài cho X1 có thể là CaO,MgO,NaOH,KOH,Zn và Fe nên loại các trường hợp oxit lưỡng tính, hidroxit lưỡng tính, muối.
TH1: X1 là oxit bazo: CaO,MgO.
Gọi CTPT chung cho X1 là MgO.
PTPU:
MO + H2SO4 → MSO4 + H2O (*) mol
0,05 0,05 0,05
Vậy KL mol của MO là: \(M_{MO}=\frac{2,8}{0,05}=56\left(g\right)\)
Vậy MO là CaO
TH2: Xét X1 là bazo: NaOH, KOH
Gọi CTPT chung cho X1 là MOH.
PTPƯ: 2MOH + H2SO4 → M2SO4 + 2H2SO4 (**)
0,1 0,05 0,05
Vậy KL mol của MOH là: \(M_{MOH}=\frac{2,8}{0,1}=28\left(g\right)\) (không có MOH thỏa mản)
TH3: X1 kim loại Zn và Fe. Gọi CTCP chung cho X1 là M.
PTPU: M + H2SO4 → MSO4 + H2 (***)
0,05 0,05 0,05
Vậy KL mol MO là \(M_M=\frac{2,8}{0,05}=56\left(g\right)\). Vậy M là Fe.
b. X1 là CaO thì X2 là \(m_{CaS\text{O4}}=0,05.136=6,8\left(g\right)\)
(khác bài ra 7,6 g) loại.
X1 là kim loại Fe thì X2 \(m_{FeS\text{O4}}=0,05.152=7,6\left(g\right)\) phù hợp với đề bài như vậy X3 là H2

M + 2HCl → MCl2 + H2↑
MO + 2HCl → MCl2 + H2O
MCl2 + 2NaOH → M(OH)2↓ + 2NaCl
M(OH)2 → MO + H2O
M + CuCl2 → MCl2 + Cu↓

Nung hỗn hợp BaCO3, Cu, FeO chỉ có BaCO3 bị nhiệt phân hủy
BaCO3 → t ∘ BaO + CO2↑ (B)
Rắn A gồm: Cu, FeO, BaO, có thể có BaCO3 dư
Khí B là CO2
CO2 + KOH → KHCO3
CO2 + 2KOH → K2CO3 + H2O
Dung dịch C gồm KHCO3 và K2CO3
KHCO3 + NaOH → K2CO3 + Na2CO3 + H2O
K2CO3 + CaCl2 → CaCO3↓ + 2KCl
A + H2O dư có phản ứng xảy ra:
BaO + H2O → Ba(OH)2
Vây dd D là Ba(OH)2
rắn E là Cu, FeO, có thể có BaCO3 dư
E + HCl dư → khí B + dd F + rắn G
BaCO3 + 2HCl → BaCl2 + CO2↑ + H2O
FeO + 2HCl → FeCl2 + H2O
Dd F gồm: BaCl2, FeCl2 và HCl dư
Rắn G là Cu
A + H2SO4 đặc => hỗn hợp khí H ( từ đây khẳng định chắc chắn A có BaCO3 dư)
BaCO3 + H2SO4 đặc → t ∘ BaSO4↓ + CO2 + H2O
Cu + 2H2SO4 đặc → t ∘ CuSO4 + SO2↑ + 2H2O
2FeO + 4H2SO4 đặc → t ∘ Fe2(SO4)3 + SO2 + 4H2O
Hỗn hợp khí H gồm: SO2 và CO2
Dung dịch I gồm: CuSO4, Fe2(SO4)3, H2SO4 đặc, nóng dư
Kết tủa K là: BaSO4.

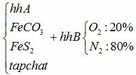
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
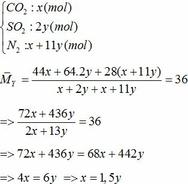
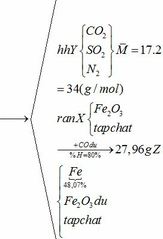
Khối lượng Fe có trong Z là:
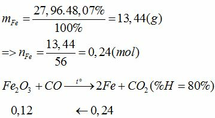
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
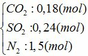
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
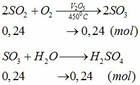
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
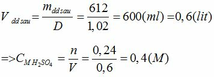



Bạn đăng câu hỏi lần lượt lên nhé .
Bài 1:
a) Từ 100kg quặng pirit sắt (có 25% tạp chất ) có thể điều chế được bao nhiêu kg H2SO4 98% (Hiệu suất của cả quá trình là 60%)
b) Tình khối lượng H2SO4 70% cần dùng để điều chế được 468kg supephôtphat kép. Hiệu suất của cả quá trình là 80%.
Bài 2:
Hòa tan m(g) kim loại R có hóa trị II vào dung dịch HCl thu được dung dịch A. Đề trung hết lượng axit dư trong dung dịch A cần 64g dung dịch NaOH 12,5%. Phản ứng làm tạo thành dung dịch B chứa 4,68% NaCl và 13,3% RCl2. Cho tiếp lượng dư NaOH vào dung dịch B rồi lọc lấy kết tủa, đem nung nóng đến khối lượng không đổi được 14g chất rắn.
a) Xác định tên kim loại R và C% của dung dịch HCl đă dùng. Tính m.
b) Hòa tan hỗn hợp gồm m (g) R và p (g) RCO3 bằng H2SO4 loăng đư được hỗn hợp khí D có tỉ khối so với H2 là 8,636. Tính p.
Bài 3:
Cho 0,04 mol hỗn hợp A có FeO và Fe2O3 tác dụng với một lượng CO ở nhiệt độ cao. Sau một thời gian phản ứng thu được 4,784g hỗn hợp chất B có 4 chất. Khí sao phản ứng được hấp thụ vào dung dịch Ba(OH)2 dư thu được 9,062g kết tủa. Hòa tan B bằng dung dịch HCl dư, thu được 0,6272 lít H2.
a) Tính % về số mol các oxit trong A.
b) Tính % về khối lương các oxit tring hỗn hợp B (Biết rằng trong B có số mol Fe2O3 bằng 1/3 số mol FeO và Fe2O3).