Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Các phản ứng oxi hóa – khử là: a; b; c và d.
a)
* Fe2O3 + CO \(\underrightarrow{t^o}\) FeO + CO2
Bước 1:
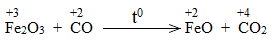
Bước 2:
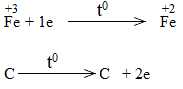
Bước 3:
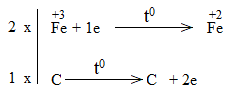
Bước 4:
Fe2O3 + CO \(\underrightarrow{t^o}\) 2FeO + CO2
Fe2O3 là chất oxi hóa.
CO là chất khử.
* FeO + CO \(\underrightarrow{t^o}\) Fe + CO2
Bước 1:
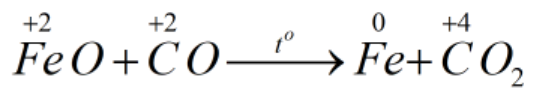
Bước 2:
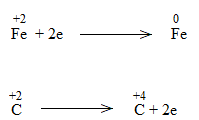
Bước 3:
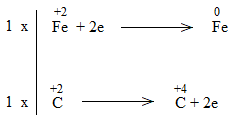
Bước 4:
FeO + CO \(\underrightarrow{t^o}\) Fe + CO2
FeO là chất oxi hóa.
CO là chất khử.
b)
* ZnS + O2 \(\underrightarrow{t^o}\) ZnO + SO2
Bước 1:
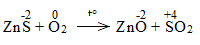
Bước 2:
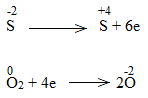
Bước 3:
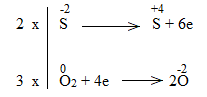
Bước 4:
2ZnS + 3O2 \(\underrightarrow{t^o}\) 2ZnO + 2SO2
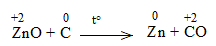
* ZnO + C \(\underrightarrow{t^o}\) Zn + CO
Bước 1:
Bước 2:
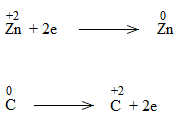
Bước 3:
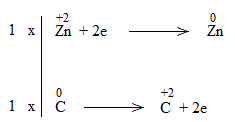
Bước 4:
ZnO + C to\(\underrightarrow{t^o}\) Zn + CO
ZnS là chất khử.
O2 là chất oxi hóa
c)
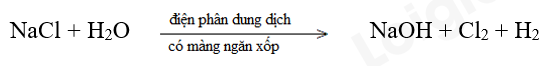
Bước 1:
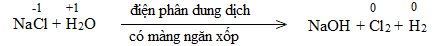
Bước 2:
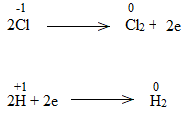
Bước 3:
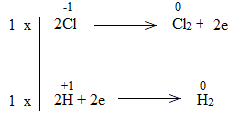
Bước 4:

NaCl là chất khử.
H2O là chất oxi hóa.
d) C2H5OH + O2 \(\underrightarrow{t^o}\) CO2 + H2O
Bước 1:
Bước 2:
Bước 3:
Bước 4:
C2H5OH + 9/2O2 \(\underrightarrow{t^o}\) 2CO2 + 6H2O
C2H5OH là chất khử.
O2 là chất oxi hóa.






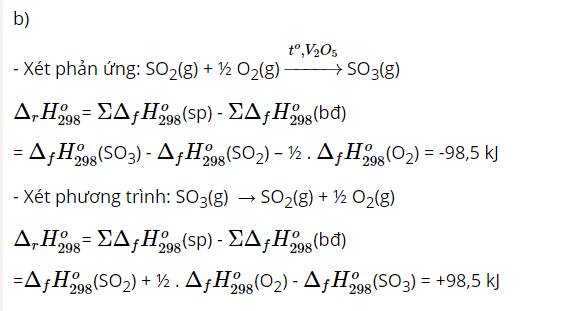
A : KMnO4
B : K2MnO4
C : MnO2
D : O2
E : HCl :
F : MnCl2
G : Cl2
H : KCl
I : KOH
L : H2
$2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2$
$MnO_2 + 4HCl \xrightarrow{t^o} MnCl_2 + Cl_2 + 2H_2O$
$2KMnO_4 + 16HCl \to 2KCl + 2MnCl_2 + 5Cl_2 + 8H_2O$
$2KCl + 2H_2O \xrightarrow{đpdd,cmn} 2KOH + H_2 + Cl_2$
$H_2 + Cl_2 \xrightarrow{as} 2HCl$