Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(6.\\a.K_C=\dfrac{\left[NH_3\right]^2}{\left[N_2\right]\left[H_2\right]^3}\\ b.K_C=\left[CO_2\right]\\ 7.\\ K_C =\dfrac{\left[NH_3\right]^2}{\left[N_2\right]\left[H_2\right]^3}=\dfrac{0,62^2}{0,45\cdot0,14^3}=311,30\)

a) \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[}}{{\rm{H}}_{\rm{2}}}{\rm{]}}}^{\rm{3}}}{\rm{[CO]}}}}{{{\rm{[C}}{{\rm{H}}_{\rm{4}}}{\rm{][}}{{\rm{H}}_{\rm{2}}}{\rm{O]}}}} = \frac{{{{1,150}^3}.0,126}}{{0,126.0,242}} \approx 6,285\]
b) CH4 (g) + H2O (g) ⇌ 3H2 (g) + CO (g)
Ban đầu: x x
Phản ứng: 0,2 ← 0,2 ← 0,6 → 0,2
Cân bằng: (x – 0,2) (x - 0,2) 0,6 0,2
Ở 760 °C:
\[\begin{array}{l}{{\rm{K}}_{\rm{C}}}{\rm{ = }}6,285\\ \Leftrightarrow \frac{{{{{\rm{[}}{{\rm{H}}_{\rm{2}}}{\rm{]}}}^{\rm{3}}}{\rm{[CO]}}}}{{{\rm{[C}}{{\rm{H}}_{\rm{4}}}{\rm{][}}{{\rm{H}}_{\rm{2}}}{\rm{O]}}}} = 6,285\\ \Leftrightarrow \frac{{{{0,6}^3}.0,2}}{{(x - 0,2)(x - 0,2)}} = 6,285\\ \Rightarrow x \approx 0,283(M)\end{array}\]

a) a, N2(g) + 3H2(g) ⇌ 2NH3(g)
\[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[N}}{{\rm{H}}_3}{\rm{]}}}^2}}}{{{\rm{[}}{{\rm{N}}_2}{\rm{][}}{{\rm{H}}_2}{{\rm{]}}^3}}}\]
b) CaCO3 (s) ⇌ CaO (s) + CO2 (g)
\[{{\rm{K}}_{\rm{C}}}{\rm{ = [C}}{{\rm{O}}_{\rm{2}}}{\rm{]}}\]

\[{{\rm{C}}_{{\rm{M(S}}{{\rm{O}}_{\rm{2}}}{\rm{)}}}}{\rm{ = }}\frac{{{\rm{0}}{\rm{,4}}}}{{\rm{1}}}{\rm{ = 0}}{\rm{,4 (M); }}{{\rm{C}}_{{\rm{M(}}{{\rm{O}}_{\rm{2}}}{\rm{)}}}}{\rm{ = }}\frac{{{\rm{0}}{\rm{,6}}}}{{\rm{1}}}{\rm{ = 0}}{\rm{,6 (M); [S}}{{\rm{O}}_{\rm{3}}}{\rm{] = }}\frac{{{\rm{0}}{\rm{,3}}}}{{\rm{1}}}{\rm{ = 0}}{\rm{,3(M)}}\]
2SO2 (g) + O2 (g) ⇌ 2SO3 (g)
Ban đầu: 0,4 0,6
Phản ứng: 0,3 ← 0,15 ← 0,3
Cân bằng: 0,1 0,45 0,3
\[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[S}}{{\rm{O}}_{\rm{3}}}{\rm{]}}}^{\rm{2}}}}}{{{{{\rm{[S}}{{\rm{O}}_{\rm{2}}}{\rm{]}}}^{\rm{2}}}{\rm{[}}{{\rm{O}}_{\rm{2}}}{\rm{]}}}} = \frac{{{{0,3}^2}}}{{{{0,1}^2}.0,45}} = 20\]

a) N2 (k) + 3H2 (k) ⇄ 2NH3 (k)
b) ta có : kc = \(\dfrac{\left[NH3\right]^2}{\left[N_2\right].\left[H_2\right]^3}=\dfrac{0.62^2}{0.45.0.14^3}33=311,3\)
c) - Tăng nhiệt độ: Hiệu suất phản ứng Giảm ( ta ví chiều thuận là chiều tăng hiệu suất phản ứng, khi tăng nhiệt độ cân bằng dịch chuyển theo chiều thu nhiệt là chiều nghịch => hiệu suất giảm)
- Tăng áp suất : Hiệu suất phản ứng tăng ( Khi tăng áp suất cân bằng dịch chuyển theo chiều làm giảm số mol khí, ta thấy vế trái có hệ 2, vế phải có hệ 3 vậy cân bằng dịch chuyển theo chiều thuận => hiệu suất tăng)
- Thêm lượng bột sắt : Không làm ảnh hưởng đến hiệu suất phản ứng ( fe là chất xúc tác khi thêm nó sẽ không làm cân bằng chuyển dịch)
KC=[NH3]2[N2].[H2]3
KC=[NH3

8. Khi tăng nhiệt độ:
+ Phản ứng CaCO3(s) ⇌ CaO(s) + CO2(g) là phản ứng thu nhiệt nên khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều giảm nhiệt độ, tức chiều thuận.
+ Phản ứng 2SO2(g) + O2(g) ⇌ 2SO3(g) là phản ứng toả nhiệt, khi tăng nhiệt độ, phản ứng chuyển dịch theo chiều giảm nhiệt độ, tức chiều nghịch.
9.
a. Khi tăng nồng độ của C2H5OH, cân bằng chuyển dịch theo chiều thuận, giảm nồng độ của C2H5OH.
b. Khi giảm nồng độ của CH3COOC2H5, cân bằng chuyển dịch theo chiều thuận, tăng nồng độ CH3COOC2H5.

Câu 1. Câu trả lời đúng: B.
Hằng số K C của một phản ứng phụ thuộc duy nhất vào bản chất của phản ứng và nhiệt độ.
Câu 2. Câu trả lời đúng: D.
Pha dịch dịch 100 lần thì nồng độ giảm 100 lần ⇒ pH tăng 2 đơn vị.

Giá trị hằng số cân bằng ở mỗi thí nghiệm:
- Thí nghiệm 1: \({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {{\rm{HI}}} \right)}^2}}}{{\left( {{{\rm{H}}_{\rm{2}}}} \right)\left( {{{\rm{I}}_{\rm{2}}}} \right)}} = \frac{{{{0,16}^2}}}{{0,02.0,02}} = 64\)
- Thí nghiệm 2: \({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {{\rm{HI}}} \right)}^2}}}{{\left( {{{\rm{H}}_{\rm{2}}}} \right)\left( {{{\rm{I}}_{\rm{2}}}} \right)}} = \frac{{{{0,18936}^2}}}{{0,00532.0,10532}} \approx 64\)
- Thí nghiệm 3: \({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {{\rm{HI}}} \right)}^2}}}{{\left( {{{\rm{H}}_{\rm{2}}}} \right)\left( {{{\rm{I}}_{\rm{2}}}} \right)}} = \frac{{{{0,19420}^2}}}{{0,20290.0,00290}} \approx 64\)
Nhận xét: Hằng số cân bằng KC của một phản ứng thuận nghịch chỉ phụ thuộc vào nhiệt độ và bản chất của phản ứng.
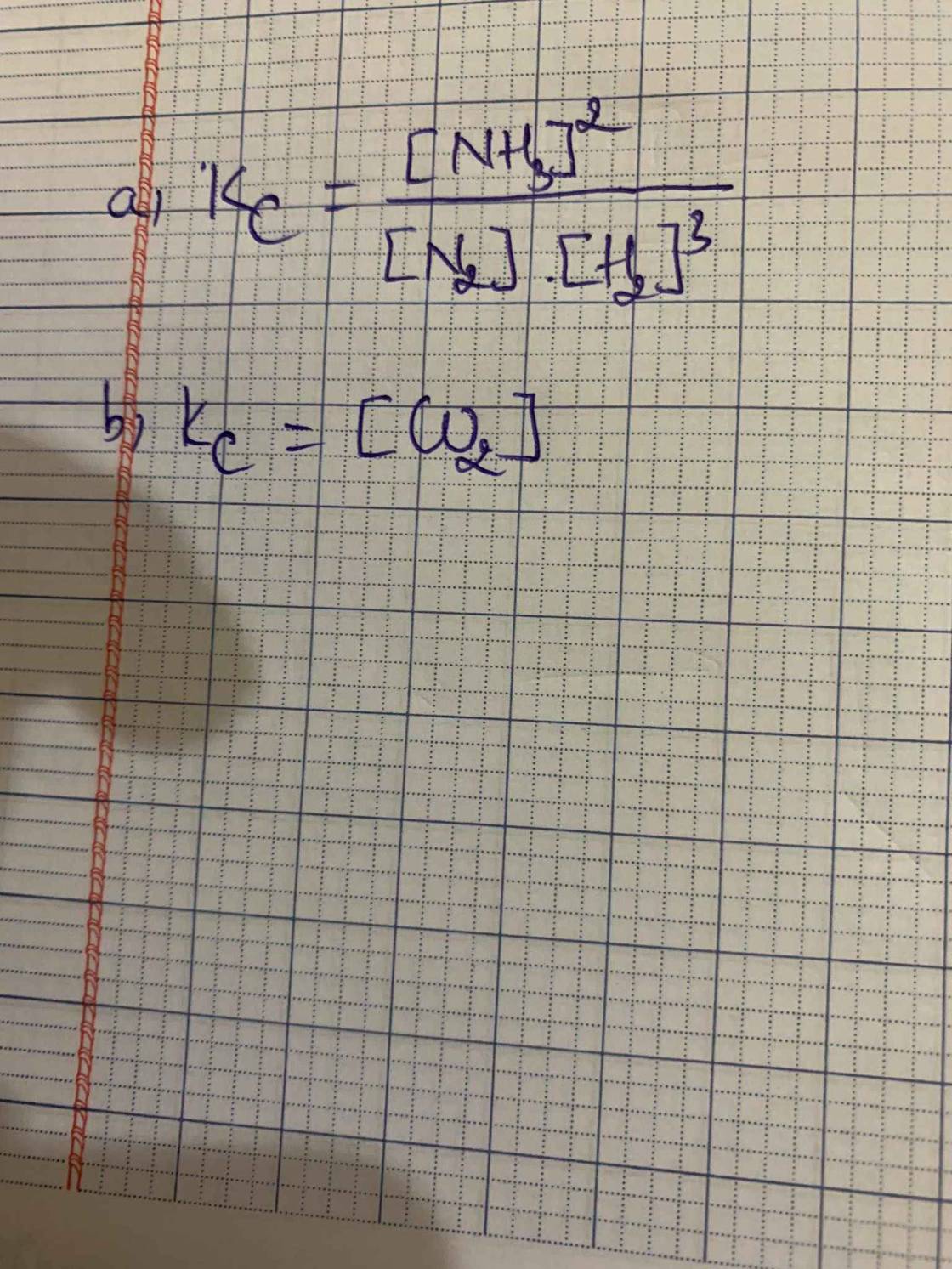
`N_2(g)+3H_2` $\leftrightharpoons$ `2NH_3(g)`
`K_C={[NH_3]^2}/{[N_2].[H_2]^3}={0,3^2}/{0,5.0,1^3}=180`
Không đáp án đúng.