Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Tổng số electron là 7, suy ra số thứ tự của nguyên tố là 7. Có 2 lớp electron suy ra nguyên tố ở chu kì 2. Nguyên tố p có 5 electron ở lớp ngoài cùng nên thuộc nhóm VA. Đó là ni tơ. Công thức phân tử hợp chất với hidro là NH3
b) Công thức electron và công thức cấu tạo của phân tử NH3
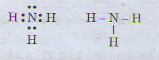

Câu 2:
Chu kỳ 3 nên M có 3 lớp e
Nhóm VIIA nên có 7e lớp ngoài cùng
\(\text{-> cầu hình e của M là 1s2 2s2 2p6 3s2 3p5 -> Z=17 -> Cl (clo)}\)
\(\text{-> Hợp chất với H của Cl là HCln với n=8-7=1 -> HCl }\)
Nguyên tố các nhóm từ IV về sau thì hợp chất với H có dạng XHn với n=8- số nhóm

ion tạo ra từ X phải có cấu hình của khí hiếm => số e ở lớp vỏ ngoài cùng = 2 (giống He) hoặc 8. Mà cấu hình của X dừng ở 3p => chỉ có đáp án B thỏa mãn => X là 1s22s22p63s23p4 (S), ion X là S2-

Kim loại chuyển tiếp là kim loại có e cuối cùng điền vào phân lớp d hoặc f. Dấu hiệu nhận biết, phân lớp d chưa đầy 10e.
R có 6 e lớp ngoài cùng => ct oxit cao nhất là RO3
Htrị của R trong hchat với H là: 8-6=2
=> ct với hợp chất Hidro: H2R
R có cấu hình e là 1s2 2s22p6 3s23p4 => R có 6e lớp ngoài cùng => R thuộc nhóm VIA.
Hóa trị cao nhất của R là VI.
=> Công thức oxit có hóa trị cao nhất là R2O6 (dựa vào quy tắc hóa trị)
=> Công thức oxit là RO3 (do chỉ số của R2O6 chưa tối giản)
=> Công thức hợp chất với hidro là H2R