Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1. \(n_{H_2SO_4\left(98\%\right)}=\dfrac{30.1,84.98\%}{98}=0,552\left(mol\right)\)
=>\(V_{H_2SO_4\left(1M\right)}=\dfrac{0,552}{1}=0,552\left(l\right)\)

Tham khảo
Khối lượng oleum chứa 71% SO3 về khối lượng cần lấy để hòa tan vào 100 gam dung dịch H2SO4 60% thì thu được oleum chứa 30% SO3 về khối lượng là:
A. 506,78gam B. 312,56 gam C. 539,68gam D. 496,68gam
Giải
x mol SO3 ,m g oleum -->80x/m = 0,71
mH2O=40 g--->nH2O=20/9 mol
SO3 + H2O--->H2SO4
--> n SO3 dư =x-20/9 ----> 80(x-20/9)/(m+100)=0,3
---->m=506,78gam

nH2SO4 = 1,8mol
H2SO4 + 3SO3 → H2SO4.3SO3 (oleum)
1,8 → 5,4
m = 5,4 . 80 = 432g

Gọi nSO3 trong oleum ban đầu là x (mol)
mH20 trong dung dịch H2SO4 96,4% là : \(\frac{100.\left(100-96,4\right)}{100}=3,6\) (g)
nH20 ................................................... là : \(\frac{3,6}{18}=0,2\) (mol)
Ta có : H20 + SO3 -> H2SO4
0,2 -> 0,2 -> 0,2 (mol)
mSO3 sau khi hấp thụ là : (x - 0,2).80 (g)
m oleum sau khi hấp thụ là : 100 + (98 + 80)x = 100 + 178x (g)
%SO3 = \(\frac{\left(x-0,2\right)80}{100+178x}=\frac{5,22}{100}\)
=> x = 0,3 (mol)
Giá trị của m là : 0,3.(98+80) = 53,4 (g)

Sửa đề:tính khối lượng SO3 cần dùng để khi hấp thụ hoàn toàn vào 200g dung dịch H2SO4 9,8% thì thu được dung dịch H2SO4 có nồng độ 20%
G:
\(m_{H_2SO_4bđ}\)=9,8%.200=19,6(g)
Gọi a là số mol SO3 cần thêm vào
=>\(m_{SO_3}\)=80a
Ta có PTHH:
SO3+H2O->H2SO4
a.......................a.........(mol)
Theo PTHH:\(m_{H_2SO_4\left(pt\right)}\)=98a
=>\(m_{H_2SO_4}\)=98a+19,6(g)
Ta có:mddsau=\(m_{SO_3}\)+mdd(axit)=80a+200
Theo gt:C%dd(sau)=20%
=>\(\dfrac{98a+19,6}{80a+200}\).100%=20%
=>9800a+1960=1600a+4000
=>8200a=2040=>a=0,25(mol)
=>\(m_{SO_3}\)=0,25.80=20(g)

\(SO_3\left(0,5\right)+H_2O\left(0,5\right)\rightarrow H_2SO_4\left(0,5\right)\)
Gọi khối lượng dung dịch H2SO4 61,25% là a.
\(\Rightarrow m_{H_2SO_4\left(bđ\right)}=0,6125a\left(g\right)\)
\(n_{SO_3}=\dfrac{40}{80}=0,5\left(mol\right)\)
Khối lượng nước tham gia phản ứng là: \(0,5.18=9\left(g\right)\)
Khối lượng H2SO4 tạo thành thêm là: \(0,5.98=49\left(g\right)\)
Khối lượng của H2SO4 có sau phản ứng là: \(49+0,6125a\left(g\right)\)
Khối lượng dung dịch sau phản ứng là: \(a+40\left(g\right)\)
Theo đề bài ta có:
\(\dfrac{49+0,6125a}{a+40}=0,735\)
\(\Leftrightarrow a=160\left(g\right)\)
Vậy khối lượng dung dịch H2SO4 ban đầu là 160 (g)
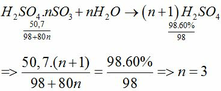
Câu 1 :
Gọi $n_{SO_3} = a(mol)$
$SO_3 + H_2O \to H_2SO_4$
Sau khi pha :
$m_{dd} = 80a + 200(gam)$
$m_{H_2SO_4} = 98a + 200.9,8\% = 98a + 19,6(gam)$
Suy ra : $C\%_{H_2SO_4} = \dfrac{98a + 19,6}{200 + 80a}.100\% = 49\%$
$\Rightarrow a = 1,333(mol)$
$m_{SO_3} = 1,333.80 = 106,64(gam)$
Gọi $m_{oleum} = a(gam) ; m_{H_2SO_4} = b(gam)$
Ta có :
Sau khi trộn :
$m_{oleum} = a + b(gam)$
$m_{SO_3} = a.71\% = 0,71a(gam)$
$\Rightarrow \%SO_3 = \dfrac{0,71a}{a + b}.100\% = 62\%$
$\Rightarrow a + b = 0,4402a$
$\Rightarrow \dfrac{a}{b} = \dfrac{1}{1 - 0,4402} = 1,78$