Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nN2O = \(\dfrac{0,616}{22,4}\)= 0,0275 mol
2N+5 + 8e --> N2+1
0,22<------- 0,0275
nNO3- tạo muối = ne trao đổi = 0,22 mol
=> mNO3- tạo muối = 0,22.62 = 13,64 gam
mMuối = mKL + mNO3- = 3,37 + 13,64 = 17,01 gam

Chất rắn không tan là Cu chưa pư.
⇒ mCu (dư) = 6 (g)
Ta có: 56nFe + 64nCu (pư) = 30 - 6 (1)
\(n_{HNO_3}=0,52.2=1,04\left(g\right)\Rightarrow n_{NO}=\dfrac{1,04}{4}=0,26\left(mol\right)\)
BT e, có: 2nFe + 2nCu (pư) = 3nNO = 0,78(2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,12\left(mol\right)\\n_{Cu\left(pư\right)}=0,27\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%m_{Cu}=\dfrac{0,27.64+6}{30}.100\%=77,6\%\)

Đáp án B
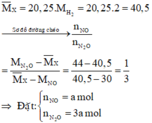
Sơ đồ phản ứng:
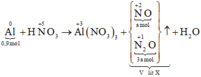
Các quá trình nhường, nhận electron:
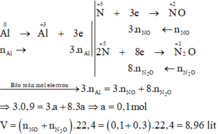

Gọi số mol Cu, M là a, b (mol)
=> 64a + b.MM = 11,2 (1)
\(n_{NO}=\dfrac{3,92}{22,4}=0,175\left(mol\right)\)
Cu0 - 2e --> Cu+2
a--->2a
M0 - ne --> M+n
b--->bn
N+5 + 3e --> N+2
0,525<-0,175
Bảo toàn e: 2a + bn = 0,525 (2)
(1)(2) => 32bn - bMM = 5,6 (3)
\(n_{H_2}=\dfrac{3,136}{22,4}=0,14\left(mol\right)\)
PTHH: 2M + 2xHCl --> 2MClx + xH2
\(\dfrac{0,28}{x}\)<---------------------0,14
=> \(\dfrac{0,28}{x}=b\) (4)
(3)(4) => MM = 32n - 20x (g/mol)
Và \(0< x\le n\)
TH1: x = n = 1 => MM = 12 (Loại)
TH2: x = n = 2 => MM = 24 (Mg)
TH3: x = n = 3 => MM = 36 (Loại)
TH4: x = 1; n = 2 => MM = 44 (Loại)
TH5: x = 1; n = 3 => MM = 76 (Loại)
TH6: x = 2; n = 3 => MM = 56 (Fe)
Vậy M có thể là Mg hoặc Fe
=> C

Giả sử: \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\\n_{Cu}=c\left(mol\right)\\n_{Al}=d\left(mol\right)\end{matrix}\right.\)
_ Khi tác dụng với HCl.
Ta có: \(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
Theo ĐLBT mol e, có: 2a + 2b + 3d = 0,45.2 ⇒ 2a + 2b + 3d = 0,9 (1)
_ Khi tác dụng với H2SO4 đặc nóng.
Ta có: \(n_{SO_2}=\dfrac{10,64}{22,4}=0,475\left(mol\right)\)
Theo ĐLBT mol e, có: 2a + 2b + 2c + 3d = 0,475.2
⇒ 2a + 2b - 2c + 3d = 0,95 (2)
Trừ 2 vế của (1) và (2), có: c = 0,025 (mol)
\(\Rightarrow\%m_{Cu}=\dfrac{0,025.64}{14,7}.100\%\approx10,88\%\)
Bạn tham khảo nhé!
Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\\n_{Cu}=c\left(mol\right)\\n_{Al}=d\left(mol\right)\end{matrix}\right.\)
Ta có: \(\left\{{}\begin{matrix}n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\\n_{SO_2}=\dfrac{10,64}{22,4}=0,475\left(mol\right)\end{matrix}\right.\)
Bảo toàn electron: \(\left\{{}\begin{matrix}2a+2b+2c+3d=0,475\cdot2\\2a+2b+3d=0,45\cdot2\end{matrix}\right.\)
\(\Rightarrow2c=0,475\cdot2-0,45\cdot2=0,05\) \(\Rightarrow c=0,025\)
\(\Rightarrow\%m_{Cu}=\dfrac{0,025\cdot64}{14,7}\cdot100\%\approx10,88\%\)




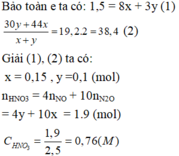
Ta có: 24nMg + 27nAl = 15,12 (1)
\(n_{HNO_3}=0,9.2=1,8\left(mol\right)\)
Mà: nHNO3 = 10nN2O ⇒ nN2O = 0,18 (mol)
BT e, có: 2nMg + 3nAl = 8nN2O = 1,44 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,36\left(mol\right)\\n_{Al}=0,24\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%m_{Mg}=\dfrac{0,36.24}{15,12}.100\%\approx57,14\%\)