
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Program (Bạn tự đặt lấy nha)
Var a, b, S: Integer
Begin
Readln(a, b);
S:=a+b;
Writeln(S);
End.
Chúc bạn học giỏi

a) Quy tắc hóa trị với hợp chất hai nguyên tố: Trong công thức hóa học, tích của chỉ số và hóa trị của nguyên tố này bằng tích của chỉ số và hóa trị của nguyên tố kia.
b) Công thức K2SO4 đúng phù hợp với quy tắc hóa trị.
2 x I = 1 x II.
b) Ta có: \(Ix2=IIx1\)
-> công thức phù hợp với quy tắc hóa trị
hóa ko phải toán ik

Ghi đúng môn học bạn nhé.
a. \(n_{CO_2}=\frac{13,2}{44}=0,3mol\)
\(\rightarrow n_C=n_{CO_2}=0,3mol\)
\(n_{H_2O}=\frac{7,2}{18}=0,4mol\)
\(\rightarrow n_H=2n_{H_2O}=0,8mol\)
\(n_{O_2}=\frac{10,08}{22,4}=0,45mol\)
Bảo toàn khối lượng \(m_X=13,2+7,2-0,45.32=6g\)
\(\rightarrow n_O=\frac{6-0,3.12-0,8}{16}=0,1mol\)
Trong X \(n_C:n_H:n_O=0,3:0,8:0,1=3:8:1\)
Vậy CTPT của X là \(C_3H_8O\)
b. \(2C_3H_8O\rightarrow9O_2\rightarrow^{t^o}6CO_2\uparrow+8H_2O\)

CTHH của than : C
Tính phân tử khối: không dẫn điện, cứng, mỗi nguyên tử được liên kết với 4 nguyên tử khác theo kiểu tứ diện, tạo thành các lưới 3 chiều gồm các vòng 6 thành viên.
Đơn vị cacbon:
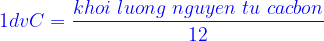
- Số avôgađrô: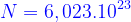
- Công thức tính khối lượng mol, số mol, khối lượng, thể tích:
+ĐKTC:
Tỉ khối hơi (d) của chất A đối với chất B(đo cùng điều kiện V,T,P)
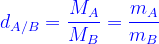
- Khối lượng riêng D:
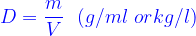
1/ Đối với chất khí ( hỗn hợp 2 khí)
- KhốI lượng mol trung bình của 1 lít hõn hợp khí ở đktc:
- Khối lượng trung bình của 1 mol hỗn hợp khí ở đktc :
Hoặc:
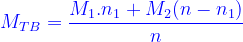 (n là tổng số mol khí trong hh)
(n là tổng số mol khí trong hh)
Hoặc:
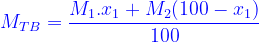 (x là % của khí thứ nhất)
(x là % của khí thứ nhất)
Hoặc: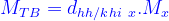
2. Đối với chất lỏng: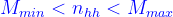
MTB của hh luôn nằm trong khoảng khối lượng mol phân tử của các chất thành phần trong hỗn hợp :
- Hỗn hợp 2 chất A, B có và có thành phần % theo số mol là a% và b%, khoảng xác định số mol của hh là:
và có thành phần % theo số mol là a% và b%, khoảng xác định số mol của hh là:
3. Khối lượng mol trung bình của một hỗn hợp
KL mol trung bình của một hh là khối lượng của 1 mol hh đó:
Trong đó:
+
+
+
+
Tính chất: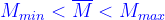
Đối với chất khí vì tỉ lệ với số mol nên (*) được viết lại thành:
Từ (*)(**) ta suy ra: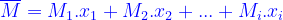 (***)
(***)
Trong đó, là thành phần % số mol hoặc thể tích (nếu hh khí) tương ứng của các chất và được lấy theo số thập phân, nghĩa là 100% tương ứng với x=1, 50% tương ứng với x=0,5
là thành phần % số mol hoặc thể tích (nếu hh khí) tương ứng của các chất và được lấy theo số thập phân, nghĩa là 100% tương ứng với x=1, 50% tương ứng với x=0,5
Chú ý: Nếu hh chỉ gồm có hai chất có khối lượng mol tương ứng M1 và M2 thì các công thức (*)(**) và (***) được viết dưới dạng
Trong đó:
Nhận xét: Nếu số mol ( hoặc thể tích ) hai chất bằng nhau thì :
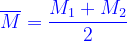
================================================== ===================
Công thức tính chương độ tan, nồng độ dung dịch:
- Công thức tính độ tan: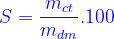
- Công thức tính nồng độ phần trăm:
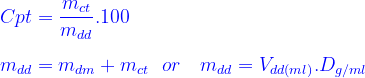
* Mối liên hệ giữa độ tan của một chất và nồng độ phần trăm dung dịch bão hòa của chất đó ở một nhiệt độ xác định:
Công thức tính nồng độ mol/l :
Trong đó: : là khối lượng chất tan (đv: gam)
: là khối lượng chất tan (đv: gam)
+
+ : là khối lượng dung môi (đv: gam)
: là khối lượng dung môi (đv: gam)
+ : là khố lượng dung dịch (đv: gam)
: là khố lượng dung dịch (đv: gam)
+V là thể tích dung dịch ( đơn vị : lít hoặc ml)
+D là khối lượng riêng của dung dịch (đv: g/ml)
+M là khối lượng mol của chất (đv: gam)
+ S là độ tan của một chất ở nhiệt độ xác định (đv:g)
+ Cpt nồng độ phần trăm của 1 chất trong dung dịch (đv: %)
méo hiểu , ghi tóm tắt 10 cái thôi , cần j dài dòng