Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
$C_2H_4 + Br_2 \to C_2H_4Br_2$
$CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O$
$CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
b) Theo PTHH :
$n_{C_2H_4} = n_{Br_2} = \dfrac{8}{160} = 0,05(mol)$
$n_{CH_4} = n_{CaCO_3} = \dfrac{15}{100} = 0,15(mol)$
$\%V_{C_2H_4} = \dfrac{0,05}{0,05 + 0,15}.100\% = 25\%$
$\%V_{CH_4} = 100\% - 25\% = 75\%$

- Phần 1 tác dụng với Br2: nBr2 = 16:160 = 0,1 mol
C2H2 + 2Br2 → C2H2Br4
0,05 ← 0,1 (mol)
- Đặt số mol khí mỗi phần như sau:
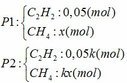
+ Số mol hỗn hợp khí X là: nX = 11,2:22,4 = 0,5 mol
Ta có: n khí P1 + n khí P2 = nX => 0,05 + x + 0,05k + kx = 0,5 <=> (x + 0,05)k = 0,45 - x
=> 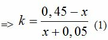
+ Đốt cháy phần 2:
C2H2 + 2,5O2 → t ∘ 2CO2 + H2O
0,05k → 0,1k→ 0,05k (mol)
CH4 + 2O2 → t ∘ CO2 + 2H2O
kx → kx → 2kx (mol)
Sản phẩm cháy gồm
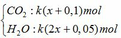
dẫn qua dung dịch Ba(OH)2 dư:
CO2 + Ba(OH)2 → BaCO3↓ + H2O
k(x+0,1) → k(x+0,1) (mol)
Khối lượng dung dịch giảm: m dd giảm = mBaCO3 – mCO2 – mH2O
=> 197k(x+0,1) – 44k(x+0,1) – 18k(2x+0,05) = 69,525
=> 153k(x+0,1) – 18k(2x+0,05) = 69,525
=> k(117x+14,4) = 69,525
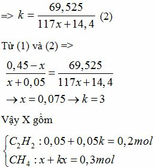
CaC2 + 2H2O → Ca(OH)2 + C2H2
0,2 ← 0,2 (mol)
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
0,1 ← 0,1 (mol)
Giá trị của m là: m = mCaC2 + mAl4C3 = 0,2.64 + 0,1.144 = 27,2 gam
Phần trăm thể tích các khí trong X là:

tác dụng với AgNO3 trong NH3 dư:
C2H2 + 2AgNO3 + 2NH3 → Ag2C2↓ + 2NH4NO3
0,15 → 0,15 (mol)
Khối lượng kết tủa thu được là: mAg2C2 = 0,15.240 = 36 gam

Cho hỗn hợp qua dung dịch brom dư
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Khí thoát ra là \(CH_4\)
\(CH_4+2O_2\rightarrow^{t^o}CO_2+2H_2O\)
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
Ta có:
\(n_{CaCO_3}=\frac{40}{100}=0,4mol=n_{CO_2}=n_{CH_4}\)
\(\rightarrow V_{CH_4}=0,4.22,4=8,96l\)
\(\rightarrow\%V_{CH_4}=\frac{8,96}{13,56}=66\%\rightarrow\%V_{C_2H_4}=34\%\)

nBr2 = 0,125 mol
Khi đốt cháy nA = 0,25 mol
mNaOH ban đầu = 36g => nNaOH = 0,9 mol
Gọi x, y lần lượt là số mol của CO2 và H2O
mdd = 180 + 44x + 18y
Vì NaOH dư do đó chỉ tạo muối trung hòa
CO2 +2NaOH → Na2CO3 + H2O
x 2x
nNaOH dư = 0,9 – 2x
có 2 , 75 % = 40 ( 0 , 9 - 2 x ) 180 + 44 x + 18 y . 100 % (1)
=> 81,21x + 0,495y = 31,05n
2,8 lít khí A tác dụng với 0,125 mol Br2
=> 5,6 lít khí A tác dụng với 0,25 mol Br2
Gọi số mol khí của CH4, C2H4 và C2H2 lần lượt là a; b; c
Ta có a + b + c = 0,25 mol
Và b + 2c = 0,25
=> a = c
=> khi đốt cháy hỗn hợp A cho nCO2 = nH2O
Thay vào (1) => x = y = 0,38 mol
Bảo toàn C, H khi đốt cháy ta có
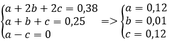
=> %VCH4 = %VC2H2 = 48%
%VC2H4 = 4%

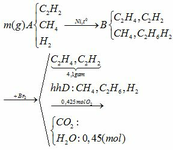
C2H2 + H2 C2H4
C2H2 + H2 C2H6
Khi cho hỗn hợp B qua dd nước Br2 chỉ có C2H4 và C2H2 phản ứng C2H2 +2Br2 → C2H2Br4
C2H4 + Br2 → C2H4Br2
=> khối lượng bình Br2 tăng chính bằng khối lượng của C2H2 và C2H4
mC2H2 + mC2H4 = 4,1 (g)
Hỗn hợp khí D đi ra là CH4, C2H6 và H2
CH4 + 2O2 → t ∘ CO2 + 2H2O
C2H6 + O2 → t ∘ 2CO2 + 3H2O
2H2 + O2 → t ∘ 2H2O
Bảo toàn nguyên tố O cho quá trình đốt cháy hh D ta có:
2nCO2 = 2nO2 – nH2O => nCO2 = ( 0,425. 2– 0,45)/2 = 0,2 (mol)
Bảo toàn khối lượng : mhh D = mCO2 + mH2O – mO2 = 0,2.44 + 0,45.18 – 0,425.32 = 3,3 (g)
Bảo toàn khối lương: mA = (mC2H2 + mC2H4) + mhh D = 4,1 + 3,3 = 7,4 (g)

Trong hai khí trên, chỉ có khí etilen tác dụng với dung dịch nước brom, khối lượng bình tăng bằng khối lượng khí etilen tham gia phản ứng, suy ra số mol của khí etilen là 2,8/28=0,1 (mol).
Khí đem đốt cháy là khí metan, số mol khí metan bằng số mol khí CO2 sinh ra (bảo toàn nguyên tố cacbon) và bằng 11/44=0,25 (mol).
a. Giá trị V=(0,25+0,1).22,4=7,84 (lít).
b. Phần trăm thể tích mỗi khí:
%Vmetan=0,25/0,35.100%\(\approx\)71,43%, suy ra %Vetilen\(\approx\)100%-71,43%\(\approx\)28,57%.

PTHH: \(CH_4+2O_2\xrightarrow[]{t^o}CO_2+2H_2O\)
Ta có: \(n_{CO_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)=n_{CH_4}\)
Đặt \(\left\{{}\begin{matrix}n_{C_2H_4}=a\left(mol\right)\\n_{C_2H_2}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow a+b=\dfrac{5,04}{22,4}-0,075=0,15\) (1)
PTHH: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
\(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
Theo PTHH: \(28a+26b=4,1\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=n_{C_2H_4}=0,1\left(mol\right)\\b=n_{C_2H_2}=0,05\left(mol\right)\end{matrix}\right.\)
Mặt khác: \(n_{hh}=\dfrac{5,04}{22,4}=0,225\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,075}{0,225}\cdot100\%\approx33,33\%\\\%V_{C_2H_4}=\dfrac{0,1}{0,225}\cdot100\%\approx44,44\%\\\%V_{C_2H_2}=22,23\%\end{matrix}\right.\)
7.
\(nCO_2=0,3(mol)\)
\(\Rightarrow nC=0,3\left(mol\right)\)
\(\Rightarrow mC=3,6\left(g\right)\)
\(nH_2O=0,4(mol)\)
\(\Rightarrow nH=0,8\left(mol\right)\)
\(\Rightarrow mH=0,8\left(g\right)\)
Ta có: \(mC+mH=3,6+0,8=4,4\left(g\right)< 6\left(g\right)\)
\(\Rightarrow\)Trong hợp chất A còn có O
\(CTDC:C_xH_yO_z\)
\(mO=6-4,4=1,6\left(g\right)\)
\(\Rightarrow nO=0,1\left(mol\right)\)
Ta có: \(x:y:z=0,3:0,8:0,1=3:8:1\)
\(\Rightarrow CTTN:\left[C_3H_8O\right]_n\)
\(\Leftrightarrow60n=60\)\(\Rightarrow n=1\)
\(\Rightarrow CTPTcuaA:C_3H_8O\)
Công thức cấu tạo: C3H8O có 3 đồng phân (bạn tự viết ra )
6.
\(\left(-C_6H_{10}O_5-\right)_n\left(\dfrac{1}{162n}\right)+nH_2O--->nC_6H_{12}O_6\left(\dfrac{1}{162}\right)\)
\(C_6H_{12}O_6\left(\dfrac{1}{162}\right)\xrightarrow[lên-men-rươu]{30-35^0C}2C_2H_5OH\left(\dfrac{1}{81}\right)+2CO_2\)
Theo PTHH (1) và (2) \(n_{C_2H_5OH}\left(lt\right)=\dfrac{1}{81}\)\((tấn mol)\)
\(\Rightarrow m_{C_2H_5OH}\left(lt\right)=\dfrac{46}{81}\left(tan\right)\)
Vì \(H_1=70\%,H_2=60\%\)
\(\Rightarrow m_{C_2H_5OH}=\dfrac{46}{81}.\dfrac{70}{100}.\dfrac{60}{100}=\dfrac{161}{675}\left(tan\right)\approx238,52\left(kg\right)\)