Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1 :
Khí là CO2 nCO2=4,4/44=0,1
Gọi muối kim loại hóa trị 1 là M2CO3
Gọi muối kim loại hóa trị 2 là NCO3
\(PTHH:M_2CO_3+2HCl\rightarrow2MCl+H_2O+CO_2\)
\(NCO_3+2HCl\rightarrow NCl_2+H_2O+CO_2\)
Ta có \(n_{CO3^{2-}}=n_{CO2}=0,1\)
\(\rightarrow m_{CO3^{2-}}=0,1.60=6\left(g\right)\)
\(\rightarrow m_M+m_N=23,8-6=17,8\)
Ta có nHCl=2nCO2=0,2=nCL
\(\rightarrow m_{muoi}=m_M+m_N+m_{Cl}=17,8+0,2.35,5=24,9\left(g\right)\)
Bài 3 :
a)
\(n_{H2}=\frac{17,92}{22,4}=0,8\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Gọi a là số mol Fe b là số mol Al
Giải hệ phương trình :
\(\left\{{}\begin{matrix}56a+27b=22\\a+\frac{1}{2}b=0,8\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,4\end{matrix}\right.\)
\(\%m_{Fe}=\frac{0,2.56}{22}.100\%=50,9\%\)
\(\%m_{Al}=100\%-50,9\%=49,1\%\)
b)
\(n_{HCl}=0,2.2+0,4.3=1,6\left(mol\right)\)
\(m_{dd_{HCl}}=\frac{1,6.36,5}{7,3\%}=800\left(g\right)\)
c)
\(m_{muoi}=m_{FeCl2}+m_{AlCl3}=0,2.127+0,4.133,5=78,8\left(g\right)\)

\(n_{H2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
Pt : \(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
a 0,4 0,2 1a
\(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
b 0,3 0,15 1b
a) Gọi a là số mol của Mg
b là số mol của Fe
\(m_{Mg}+m_{Fe}=13,2\left(g\right)\)
⇒ \(n_{Mg}.M_{Mg}+n_{Fe}.M_{Fe}=13,2g\)
⇒ 24a + 56b = 13,2g (1)
Theo phương trình : 1a + 1b = 0,35(2)
Từ(1),(2), ta có hệ phương trình :
24a + 56b = 13,2g
1a + 1b = 0,35
⇒ \(\left\{{}\begin{matrix}a=0,2\\b=0,15\end{matrix}\right.\)
\(m_{Mg}=0,2.24=4,8\left(g\right)\)
\(m_{Fe}=0,15.56=8,4\left(g\right)\)
0/0Mg = \(\dfrac{4,8.100}{13,2}=36,36\)0/0
0/0Fe = \(\dfrac{8,4.100}{13,2}=63,64\)0/0
b) \(n_{HCl\left(tổng\right)}=0,4+0,3=0,7\left(mol\right)\)
200ml = 0,2l
\(C_{M_{ddHCl}}=\dfrac{0,7}{0,2}=3,5\left(M\right)\)
c) \(m_{muối.clorua}=\left(0,2.95\right)+\left(0,15.127\right)=38,05\left(g\right)\)
Chúc bạn học tốt

\(a,Fe+2HCl\rightarrow FeCl_2+H_2\\ CuO+2HCl\rightarrow CuCl_2+H_2O\\ n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\Rightarrow n_{Fe}=n_{H_2}=0,1\left(mol\right)\\ \Rightarrow\%m_{Fe}=\dfrac{0,1.56}{13,6}.100\%\approx41,176\%\\ \Rightarrow\%m_{CuO}\approx58,824\%\\ b,n_{CuO}=\dfrac{13,6-0,1.56}{80}=0,1\left(mol\right)\\ n_{HCl\left(p.ứ\right)}=2.\left(n_{Fe}+n_{CuO}\right)=2.\left(0,1+0,1\right)=0,4\left(mol\right)\\ \Rightarrow V_{ddHCl}=\dfrac{0,4}{2}=0,2\left(l\right)\)

Gọi số mol Na, Zn là a, b
=> 23a + 65b = 14,3
n H2=\(\dfrac{2,24}{22,4}\)=0,1 mol
- Nếu Zn tan hết
2Na + 2H2O --> 2NaOH + H2
a-------------------->a---->0,5a
2NaOH + Zn --> Na2ZnO2 + H2
2b<----b-------------------->b
->\(\left\{{}\begin{matrix}2b\text{≤}a\\0,5a+b=14,3\end{matrix}\right.\) loại
=> Zn không tan hết => NaOH hết
PT:2Na + 2H2O --> 2NaOH + H2
a------------------->a---->0,5a
2NaOH + Zn --> Na2ZnO2 + H2
\ a--------------------------->0,5a
=> 0,5a + 0,5a = 0,1
=> a = 0,1
=> mNa = 0,1.23 = 2,3 (g)
=> mZn = 14,3 - 2,3 = 12(g)
PTP. ứng:
Fe+S----> FeS
Fe+ 2HCl--> FeCl2+H2
x x (mol)
FeS+ 2HCl--> FeCl2+ H2S
y y (mol)
Gọi n H2 và H2S trong C lần lượt là x và y mol, ta có hpt:
x+y=0.1
(2x+32y)/2(x+y)=13
--> x=0.02, y=0.08
--> tổng m Fe+n FeS= n Fe tỏng A=x+y=0.1 mol
m Fe=0.1.56=5.6 (g)

nH2= 0,35(mol)
a) PTHH: Mg + 2 HCl -> MgCl2 + H2
x_________2x_______x______x(mol)
PTHH: Fe + 2 HCl -> FeCl2 + H2
y________2y________y_____y(mol)
Ta có hpt: \(\left\{{}\begin{matrix}24x+56y=13,2\\x+y=0,35\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,15\end{matrix}\right.\)
b) m=m(muối khan)= mMgCl2 + mFeCl2= 95.x+127y=95.0,2+127.0,15= 38,05(g)
a)
Gọi
\(n_{Fe} = a(mol) ; n_{Mg} = b(mol)\\ \Rightarrow 56a + 24b = 13,2(1)\)
\(Mg + 2HCl \to MgCl_2 + H_2\\ Fe + 2HCl \to FeCl_2 + H_2\)
Theo PTHH : \(n_{H_2} = a + b = 0,35(mol)\)(2)
Từ (1)(2) suy ra a = 0,15 ;b = 0,2
Vậy :
\(\%m_{Fe} = \dfrac{0,15.56}{13,2}.100\% = 63,64\%\\ \Rightarrow m_{Mg} = 100\% - 63,64\% = 36,36\%\)
b)
Ta có :\(n_{HCl} = 2n_{H_2} = 0,7(mol)\)
Bảo toàn khối lượng :
\(m_{muối} = m_{kim\ loại} + m_{HCl} - m_{H_2} = 13,2 + 0,7.36,5 - 0,35.2=38,05(gam)\)

Sửa đề: đktc → đkc
a, \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: 24nMg + 56nFe = 13,2 (1)
\(n_{H_2}=\dfrac{8,6765}{24,79}=0,35\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Mg}+n_{Fe}=0,35\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,2\left(mol\right)\\n_{Fe}=0,15\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,2.24}{13,2}.100\%\approx36,36\%\\\%m_{Fe}\approx63,64\%\end{matrix}\right.\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{MgCl_2}=n_{Mg}=0,2\left(mol\right)\\n_{FeCl_2}=n_{Fe}=0,15\left(mol\right)\end{matrix}\right.\)
⇒ m muối khan = 0,2.95 + 0,15.127 = 38,05 (g)

\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\\ PTHH:2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Fe+2HCl\rightarrow FeCl_2+3H_2\\ Đặt:n_{Al}=a\left(mol\right);n_{Fe}=b\left(mol\right)\left(a,b>0\right)\\ \Rightarrow\left\{{}\begin{matrix}27a+56b=11\\1,5a+b=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\\ a,n_{HCl}=2.n_{H_2}=2.0,4=0,8\left(mol\right)\\ \Rightarrow V_{ddHCl}=\dfrac{0,8}{8}=0,1\left(l\right)\\ b,FeCl_2+2AgNO_3\rightarrow Fe\left(NO_3\right)_2+2AgCl\downarrow\\ AlCl_3+3AgNO_3\rightarrow Al\left(NO_3\right)_3+3AgCl\downarrow\\ n_{AgCl}=n_{AgNO_3}=3.n_{AlCl_3}+2.n_{FeCl_2}=3.a+2.b=3.0,2+2.0,1=0,8\left(mol\right)\\ \Rightarrow a=\dfrac{170.0,8}{250}.100=54,4\%\\ b=m_{\downarrow}=m_{AgCl}=0,8.143,5=114,8\left(g\right)\)

\(n_{H_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(0.15.....0.3.......................0.15\)
\(m_{Mg}=0.15\cdot24=3.6\left(g\right)\)
\(m_{Cu}=10-3.6=6.4\left(g\right)\)
\(\%Mg=\dfrac{3.6}{10}\cdot100\%36\%\)
\(\%Cu=64\%\)
\(V_{dd_{HCl}}=\dfrac{0.3}{2}=0.15\left(l\right)\)

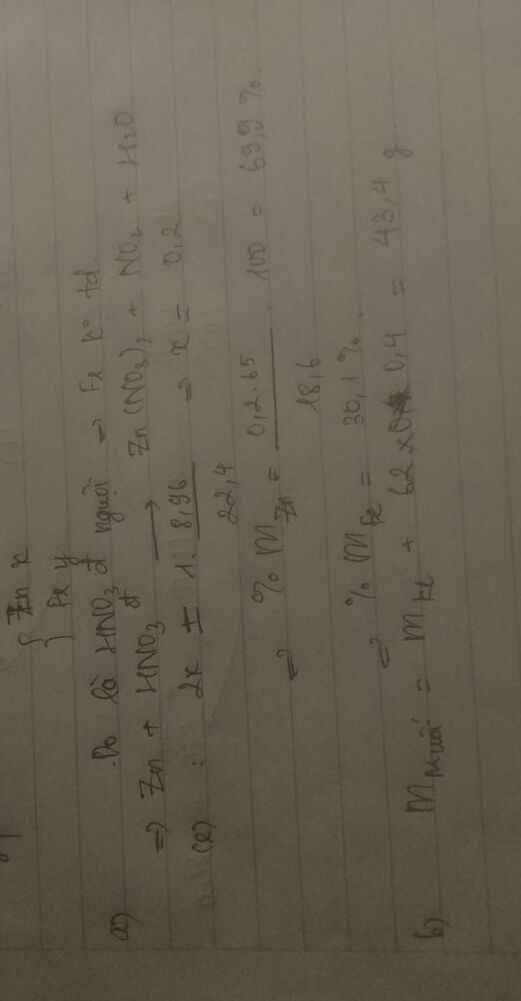

a, Chỉ Fe tạo khí
nH2= 1,68/22,4= 0,075 mol
Fe+ 2HCl -> FeCl2+ H2 (1)
=> nFe= nFeCl2= 0,075 mol; nHCl(1)= 0,15 mol
mFe= 0,075.56= 4,2g
=> mCuO= 14,2-4,2= 10g
b,
nCuO= 10/80= 0,125 mol
CuO+ 2HCl -> CuCl2+ H2O (2)
=> nCuCl2= 0,125 mol; nHCl(2)= 0,25 mol
Tổng mol HCl= nHCl(1)+ nHCl(2)= 0,4 mol
=> CM HCl= 0,4/0,1= 4M
c,
CM FeCl2= 0,075/0,1= 0,75M
CM CuCl2= 0,125/0,1= 1,25M
C2
a,
nH2= 17,92/22,4= 0,8 mol
Fe+ 2HCl -> FeCl2+ H2
2Al+ 6HCl -> 2AlCl3+ 3H2
Gọi x là mol Fe, y là mol Al
Ta có hệ: 56x+ 27y= 22 và x+ 1,5y= 0,8
<=> x= 0,2; y= 0,4
%Fe= 0,2.56.100220,2.56.10022= 50,9%
%Al= 49,1%
b,
nHCl= 2nH2= 1,6 mol
=> mHCl= 1,6.36,5= 58,4g
=> mdd HCl= 58,4.1007,358,4.1007,3= 800g
c,
mH2= 0,8.2= 1,6g
BTKL, m muối= 22+58,4-1,6= 78,8g
Bài 1 :
a)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
\(n_{H2}=\frac{1,68}{22,4}0,075\left(mol\right)\)
\(\rightarrow n_{Fe}=n_{H2}=0,075\left(mol\right)\)
\(m_{Fe}=0,075.56=4,2\left(g\right),m_{CuO}=14,2-4,2=10\left(g\right)\)
\(n_{CuO}=\frac{10}{80}=0,125\left(mol\right)\)
\(n_{HCl}=0,075.2+0,125.2=0,4\left(mol\right)\)
\(CM_{HCl}=\frac{0,4}{0,1}=4M\)
c)
\(CM_{FeCl2}=\frac{0,075}{0,1}=0,75M\)
\(CM_{CuCl2}=\frac{0,125}{0,1}=1,25M\)
Bài 2 :
a)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(n_{H2}=\frac{17,92}{22,4}=0,8\left(mol\right)\)
Gọi a là nFe b là nAl
Giải hệ phương trình :
\(\left\{{}\begin{matrix}56a+27b=22\\a+\frac{1}{2}b=0,8\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,4\end{matrix}\right.\)
\(\%m_{Fe}=\frac{0,2.56}{22}.100\%=50,9\%\)
\(\%m_{Al}=100\%-50,9\%=49,1\%\)
b)
\(n_{HCl}=0,8.2=1,6\left(mol\right)\)
\(m_{dd_{HCl}}=\frac{1,6.36,5}{7,3\%}=800\left(g\right)\)
c)
\(m_{muoi}=0,2.127+0,4.133,5=78,8\left(g\right)\)