Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

$n_{SO_2} = n_S = \dfrac{a}{32}(mol)$
$n_{NaOH} = 0,2b(mol)$
Ta thấy : d > c
Chứng tỏ X gồm hai muối $Na_2SO_3$ và $NaHSO_3$
Suy ra :
$1 < n_{NaOH} : n_{SO_2} < 2$
$⇔ 1< 0,2b : \dfrac{a}{32} < 2$
$⇔ \dfrac{a}{32} < 0,2b < \dfrac{a}{16}$
$⇔ \dfrac{5a}{32} < b < \dfrac{5a}{16}$

. Chép lại đề :
-Cho 18,36 gam BaO vào nước (dư) thu dung dịch X
- Cho 18,4 gam hỗn hợp gồm CaCO3 và MgCO3 vào HCl dư thu khí Y
Hấp thụ hoàn toàn Y vào X có thu được kết tủa không
__________________________Bài Làm__________________________
PTP/Ư 1 : ( Cho BaO vào nước )
BaO + H2O\(\rightarrow\) Ba(OH)2 (dung dịch X )
PTP/Ư 2 và 3 : ( Cho hỗn hợp gồm CaCO3 và MgCO3 vào HCl )
(2) CaCO3 + HCl \(\rightarrow\) CaCl2 + H2O + CO2 \(\uparrow\)
(3) MgCO3 + HCl \(\rightarrow\) MgCl2 + H2O + CO2 \(\uparrow\)
Khí Y thu được là CO2
PTP/Ư 3 : Hấp thụ hoàn toàn khí Y vào dung dịch X :
CO2 + Ba(OH)2 \(\rightarrow\) BaCO3\(\downarrow\) + H2O
Vậy khi hấp thụ khí Y vào X thì thu được kết tủa là BaCO3

Fe3O4+4CO=>3Fe+ 4CO2
CuO+CO=>Cu+CO2
Cr B gồm Fe Cu
HH khí D gồm CO dư và CO2
CO2 +Ca(OH)2=>CaCO3+H2O
p/100 mol<= p/100 mol
2CO2+Ca(OH)2 => Ca(HCO3)2
p/50 mol
Ca(HCO3)2+ 2NaOH=>CaCO3+ Na2CO3+2H2O
p/100 mol p/100 mol
Tổng nCO2=0,03p mol=nCO
=>BT klg
=>m+mCO=mCO2+mB=>mB=m+0,84p-1,32p=m-0,48p
c) hh B Fe+Cu
TH1: Fe hết Cu chưa pứ cr E gồm Ag Cu
dd Z gồm Fe(NO3)2
Fe+2Ag+ =>Fe2+ +2Ag
TH2:Cu pứ 1p cr E gồm Cu và Ag
Fe+2Ag+ => Fe2+ +2Ag
Cu+2Ag+ =>Cu2+ +2Ag
Dd Z gồm 2 muối của Fe2+ và Cu2+

Cho hỗn hợp X vào dung dịch HCl lấy dư:
PTHH: Al2O3 + 6HCl → 2AlCl3 + 3H2O
MgO + 2HCl → MgCl2 + H2O
Fe + 2HCl → FeCl2 + H2
Dung dịch Y gồm: AlCl3, MgCl2, FeCl2, HCl dư
Khí Z là H2
Chất rắn A là Cu
Cho A tác dụng với H2SO4 đặc nóng.
PTHH: Cu + 2H2SO4(đặc, nóng) → CuSO4 + SO2 + 2H2O
Khí B là SO2
Cho B vào nước vôi trong lấy dư
PTHH: SO2 + Ca(OH)2 → CaSO3 + H2O
Kết tủa D là CaSO3
Cho dung dịch NaOH vào Y tới khi kết tủa lớn nhất thì dừng lại.
PTHH: NaOH + HCl → NaCl + H2O
3NaOH + AlCl3 → Al(OH)3 + 3NaCl
2NaOH + MgCl2 → Mg(OH)2 + 2NaCl
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
Chất rắn E là: Al(OH)3, Mg(OH)2, Fe(OH)2
Nung E trong không khí
Chất rắn G là Al2O3, MgO, Fe2O3

- Phần 1 tác dụng với Br2: nBr2 = 16:160 = 0,1 mol
C2H2 + 2Br2 → C2H2Br4
0,05 ← 0,1 (mol)
- Đặt số mol khí mỗi phần như sau:
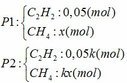
+ Số mol hỗn hợp khí X là: nX = 11,2:22,4 = 0,5 mol
Ta có: n khí P1 + n khí P2 = nX => 0,05 + x + 0,05k + kx = 0,5 <=> (x + 0,05)k = 0,45 - x
=> 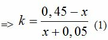
+ Đốt cháy phần 2:
C2H2 + 2,5O2 → t ∘ 2CO2 + H2O
0,05k → 0,1k→ 0,05k (mol)
CH4 + 2O2 → t ∘ CO2 + 2H2O
kx → kx → 2kx (mol)
Sản phẩm cháy gồm
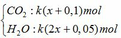
dẫn qua dung dịch Ba(OH)2 dư:
CO2 + Ba(OH)2 → BaCO3↓ + H2O
k(x+0,1) → k(x+0,1) (mol)
Khối lượng dung dịch giảm: m dd giảm = mBaCO3 – mCO2 – mH2O
=> 197k(x+0,1) – 44k(x+0,1) – 18k(2x+0,05) = 69,525
=> 153k(x+0,1) – 18k(2x+0,05) = 69,525
=> k(117x+14,4) = 69,525
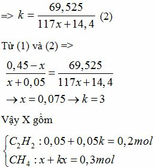
CaC2 + 2H2O → Ca(OH)2 + C2H2
0,2 ← 0,2 (mol)
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
0,1 ← 0,1 (mol)
Giá trị của m là: m = mCaC2 + mAl4C3 = 0,2.64 + 0,1.144 = 27,2 gam
Phần trăm thể tích các khí trong X là:

tác dụng với AgNO3 trong NH3 dư:
C2H2 + 2AgNO3 + 2NH3 → Ag2C2↓ + 2NH4NO3
0,15 → 0,15 (mol)
Khối lượng kết tủa thu được là: mAg2C2 = 0,15.240 = 36 gam

- P1 :
CH3COOH + Na -> CH3COONa + ½ H2
CnH2n+1OH + Na -> CnH2n+1ONa + ½ H2
=> mrắn sau = mmuối + mNa dư = mX(1) + 5
Bảo toàn khối lượng : mX(1) + mNa = mrắn sau + mH2
=> nH2 = 0,05 mol => nX(1) = 0,1 mol => naxit = nancol = 0,05 mol
=> mX(1) = 60.0,05 + (14n + 18).0,05 = 3,9 + 0,7n
=> mX(2) = 7,6 – 0,7n
- P2 : Đốt cháy hoàn toàn X(2)
C2H4O2 + 2O2 -> 2CO2 + 2H2O
CnH2n+2O + 1,5nO2 -> nCO2 + (n+1)H2O
CO2 + Ca(OH)2 -> CaCO3 + H2O
2CO2 + Ca(OH)2 -> Ca(HCO3)2
Ca(HCO3)2 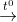 CaCO3 + CO2 + H2O
CaCO3 + CO2 + H2O
Bảo toàn C : nCO2 = nCaCO3(đầu) + 2nCaCO3(sau) = 0,225 mol
=> nX(2) = 0,45/(2+n) (mol)
Mà số mol 2 chất bằng nhau => nX(1) : nX(2) = mX(1) : mX(2)
=> (3,9 + 0,7n).0,45/(2 + n) = (7,6 – 0,7n).0,1
=> n = 1
Vậy ancol là CH3OH

1, PTHH :
(1) S + O2 --> SO2
(2) SO2 + NaOH --> NaHSO3
(3) SO2 + 2 NaOH --> Na2SO3 + H2O
Phần I : tác dụng với dung dịch CaCl2 sinh kết tủa .
=> X có chứa Na2SO3.
Phần II tác dụng với dung dịch Ca(OH)2 sinh nhiều kết tủa hơn.
=> dung dịch X có muối NaHSO3
(4) Na2SO3 + CaCl2 --> CaSO3 + 2NaCl
(5) Na2SO3 + Ca(OH)2 -->CaSO3 + 2NaOH
(6) NaHSO3 + Ca(OH)2 --> CaSO3 + NaOH + H2O
\(n_S=\dfrac{a}{32}\left(mol\right)\), nNaOH = 0,2 b ( mol)
Theo bài ra : d > c .
Theo (2),(3), để SO2 tác dụng với dung dịch NaOH sinh 2 loại muối thì :
\(1< \dfrac{n_{NaOH}}{n_S}< 2\)
\(=>1< \dfrac{6,4b}{a}< 2\)
\(=>3,2b< a< 6,4b\)
...