Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1.Trong các hiđrohalogenua, tính khử tăng theo thứ tự sau:
a) HF<HCl<HBr<HI
b) HCL<HI<HBR<HF
c) HF<HBR<HCL<HI
d) HI< HBr<HCL<HF
2) A
Do nguyên tử I có bán kính lớn nhất trong các halogen nên liên kết H-I là dài nhất trong các liên kết H-X của hidro halogenua \(\rightarrow\) Liên kết dễ bị phá vỡ nhất vì vùng xen phủ ở xa hạt nhân nhất\(\rightarrow\) H trong HI dễ dàng bị tách ra tạo ion H+. Vậy HI có tính axit mạnh nhất.
3) D
Trong nhóm halogen, flo có độ âm điện lớn nhất nên dễ dàng hút e về phía mình tạo ion F-. Vậy F2 có tính oxh lớn nhất.

Bài 2 :
a,
\(3Cl_2+2Fe\rightarrow2FeCl_3\)
\(3NaOH+FeCl_3\rightarrow3NaCl+Fe\left(OH\right)_3\)
\(NaCl+AgNO_3\rightarrow AgCl+NaNO_3\)
b, \(3H_2SO_4+10HCl+2KMnO_4\rightarrow5Cl_2+8H_2O+2MnSO_4+K_2SO_4\)
\(Cl_2+2NaOH\rightarrow NaClO+NaCl+H_2O\)
\(NaClO+H_2O+CO_2\rightarrow NaHCO_3+HClO\)
c,
\(MnO_2+HCl\rightarrow Cl_2+2H_2O+MnCl_2\)
\(Cl_2+NaBr\rightarrow NaCl+Br_2\)
\(Br_2+NaI\rightarrow NaBr+I_2\)
\(I_2+2Na_2S_2O_3\rightarrow2NaI+Na_2S_4O_6\)
B1: Cân bằng phản ứng hoá học theo phương pháp thăng bằng e và xác định vt các chất khi tham gia phản ứng a. KOH+Cl2 -> KClO3 +KCl + H2O b. NH3+ CuO -> N2+ Cu+

2) 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Cl2 + H2 = 2HCl ( điều kiện ánh sáng )
2HCl + Fe = FeCl2 + H2
FeCl2 + 2AgNO3 = 2AgCl + Fe(NO3)2
2AgCl = 2Ag + Cl2

Ca +F2 ---> CaF2
2KClO3 ---> 2KCl + 3O2
NaCl + AgNO3 ---> AgCl + NaNO
2AgCl --to---> 2Ag + Cl2
Cl2 không phản ứng với Ag
FeCl3 + 3AgNO3 ---> Fe(NO3)3 +3AgCl
2Fe + 3Cl2 --> 2FeCl2
5Cl2 + Br2 +6H2O ---> 10HCl +2HBrO3
2HCl + CaOCl2 ---> CaCL2 + Cl2 + H2O
2Fe3O4 + 16HCl + Cl2 -> 6FeCl3 + 8H2O
Al+3FeCl3→AlCl3+3FeCl2
6FeCL2 + 3BR2 -> 2FeBr3 + 4FeCl3
2HCl + Fe -> FeCl2 + H2
H2S + 4Cl2+4H2O-->H2SO4 +8HCl
24 H2SO4 + 6 KMnO4 + 10 FeCl2 → 24 H2O + 10 Cl2 + 3 K2SO4 + 6MnSO4 + 5 Fe2(SO4)3
H2SO4+2HBr→Br2+2H2O+SO2 Br2+2H2O+SO2→H2SO4+2HBr
Cl2+2NaBr→Br2+2NaCl
Br2+2NaI→I2+2NaBr2
2FeSO4 + H2SO4 + Cl2 → Fe2(SO4)3 + 2HCl
H2O2+H2SO4+KI→H2O+I2+K2SO4

1.
\(CaF_2+H_2SO_{4_{dac}}\underrightarrow{^{to}}CaSO_4+HF\)
\(2HF\underrightarrow{^{to}}F_2+H_2\)
\(F_2+Cu\underrightarrow{^{to}}CuF_2\)
\(CuF_2+2HCl\rightarrow CuCl_2+2HF\)
\(4HF+SiO_2\rightarrow SiF_4+2H_2O\)
2.
\(Ca\left(OH\right)_2+Cl_2\rightarrow CaOCl_2+H_2O\)
\(2CaOCl_2+H_2O+CO_2\rightarrow CaCO_3+CaCl_2+2HClO\)
\(CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\)
\(NaClO+CO_2+H_2O\rightarrow NaHCO_3+HClO\)
\(NaOH+HClO\rightarrow H_2O+NaClO\)
3.
\(2NaBr+Cl_2\rightarrow2NaCl+Br_2\)
\(Br+H_2O⇌HBr+HBrO\)
\(HBrO+NaOH\rightarrow NaBrO+H_2O\)
4.
\(2HCl+CuO\rightarrow CuCl_2+H_2O\)
\(CuCl_2+2KOH\rightarrow Cu\left(OH\right)_2+2KCl\)
\(2KCl+2H_2O\underrightarrow{^{to}}2KOH+Cl_2+H_2\)
\(6KOH_{dac}+3Cl_2\underrightarrow{^{to}}KClO_3+5KCl+3H_2O\)
\(2KClO_3\underrightarrow{^{to}}2KCl+3O_2\)

1)Thể tích dd NaOH 2M cần dùng để trung hoà 20g dd HCl 14,6% là
A. 20 ml B. 40 ml C. 60 ml D. 80 ml
-Trả lời:
NaOH + HCl => NaCl + H2O
mHCl = 20x14.6/100 = 2.92 g
==> nHCl = m/M = 2.92/36.5 = 0.08 (mol)
Theo phương trình ==> nNaOH = 0.08 (mol)
VddNaOH = n/CM = 0.08/2 = 0.04 (l) = 40ml
===> Chọn B
2)Hoà tan hoàn toàn m gam hỗn hợp Zn và ZnO bằng lượng vừa đủ 250 ml dd HCl 7,3% (D=1,2 g/ml) thu được 4,48 lít khí và dd X. Nồng độ phần trăm của muối trong X là
A. 19,08% B. 13,06% C. 8,48% D. 12,72%
-Trả lời:
Zn + 2HCl => ZnCl2 + H2 (1)
ZnO + 2HCl => ZnCl2 + H2O (2)
nH2 = V/22.4 = 4.48/22.4 = 0.2 (mol)
==> nZn = 0.2 (mol) = nZnCl2(1)
mHCl = 7.3x250/100 = 18.25 (g)
==> nHCl = m/M = 0.5 (mol)
==> mZn = 13 (g)
nZnO = (0.5 - 0.4)/2 = 0.05 => mZnO = 4.05 (g)
m = mZn + mZnO = 17.05 (g)
mdd sau pứ = 250 + 17.05 - 0.2x2 = 266.65 (g)
mZnCl2 = n.M = 0.25 x 136 = 34 (g)
C% = 34x100/266.65 = 12.75 %
3)Dãy nào sau đây gồm các chất vừa có oxi hoá vừa có tính khử
A. S, Cl2, Br2
B. S, Cl2, F2
C. Cl2, O2, S
D. O3, Cl2, H2S
4)Cho các chất sau: CuO, BaCl2, Ag, C, NaHCO3. Số chất tác dụng được với dung dịch H2SO4 đặc nóng là:
A. 3 B. 4 C. 5 D. 2
5)Cho các sơ đồ phản ứng sau
(1)CuO+H2SO4 đặc, nóng-------> (2)S+H2SO4 đặc, nóng--------->
(3)FeS+HCl-------->
(4)FeO+H2SO4 đặc, nóng--------->
Số phản ứng sinh ra chất khí là
A. 2 B. 1 C. 3 D. 4
6)Cho dãy chuyển hoá: X-->Y-->Z-->T-->Na2SO4. X,Y,Z,T theo thứ tự có thể là dãy chất nào sau đây
A. FeS2, S, SO3, H2SO4
B. SO2, SO3, S, NaHSO3
C. CuS, H2S, H2SO4, NaHSO3
D. FeS2, SO2, SO3, H2SO4

Câu 2: Chỉ dùng một thuốc thử nhận biết các chất đựng riêng biệt trong các lọ mất nhãn sau: NaCl, NaF, NaBr, NaI
cho AgNo3 vào từng mẫu thử
NaBr kết tủa vàng nhạt
NaI kết tủa vàng cam
NaCl kết tủa trắng
NaF không kết tủa
Câu 3: Viết phương trình hóa học chứng minh tính oxi hóa của Cl2 > Br2 > I2
a, Cl2 + NaBr → Br2 + NaCl và Br2 + NaI → I2 + NaBr
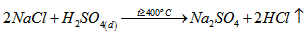
Câu 4: Giải thích tại sao: a, Khi điều chế khí hiđro clorua phải dùng muối NaCl tinh thể và axit H2SO4 đậm đặc b, Không dùng bình thủy tinh để đựng dung dịch HF
Phải dùngH2SO4đặc và muối ở trạng thái tinh thể để hiđro clorua tạo thành không hoà tan trong nước.
ko dùng bình thủy tinh để đựng dd HFvì HF có thể td với thủy tinh
bài 6
2Al+6HCl----.2AlCl3 +3H2(1)
x-------3x---------x------1,5x
Fe+2HCl----.>FeCl2+H2(2)
y------2y------------y------y
Ta có
nH2=8,96/22,4=0,4(mol)
Ta có hệ pt
{27x+56y=111,5
x+y=0,4⇒{x=0,2,y=0,1
%mAl=Al=0,2.27/11.100%=49,09%
%mFe=100−49,09=50,91%
b) Theo pthh
nHCl=2nH2=0,8(mol)
mHCl=0,8.36,5=29,2(g)
mdd=29,2.100/10=292(g)
câu 7
nNaOH = 0,5 x 4 = 2 mol
a) Phương trình hóa học của phản ứng :
MnO2 + 4 HCl → MnCl2 + Cl2 +2H2O
0,8 mol 0,8mol 0,8 mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,8 mol → 1,6 mol 0,8mol 0,8mol
b) Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM(NaCl) = = CM(NaClO) =
= 1,6 mol/l
CM(NaOH)dư = = 0,8 mol/l
1. Để dung dịch H2S lâu ngày trong không khí thì có hiện tượng dung dịch dần trở nên vẩn đục và có màu vàng do Oxi trong không khí đã Oxi hóa chậm H2S thành
H2S + O2 --> SO2 + H2O
(Xin lỗi ở trên mik quên ko cân bằng phương trình)
1. Để dung dịch H2S lâu ngày trong không khí thì có hiện tượng dung dịch dần trở nên vẩn đục và có màu vàng do Oxi trong không khí đã Oxi hóa chậm H2S thành
2H2S + 3O2 --> 2SO2 + 2H2O