Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Điều kiện cần thiết cho một vật có thể cháy được và tiếp tục cháy được: chất phải nóng đến nhiệt độ cháy, phải đủ khí oxi cho sự cháy.

Điều kiện cần thiết cho một vật có thể cháy được và tiếp tục cháy được: chất phải nóng đến nhiệt độ cháy, phải đủ khí oxi cho sự cháy.

Bài 3 :
vì nồng độ oxi trong ko khí loãng hơn so với trong khí oxi nguyên chất (tinh khiết)
Bài 4 :
sự cháy thì phát ra nhiệt và ánh sáng còn sự oxi hoá chậm chỉ phát ra nhiệt
Bài 5:
cần có đủ oxi và đủ điều kiện để tạo ra phản ứng gây cháy
Bài 6:
vì trọng lượng riêng (khối lượng riêng) của nước lớn hơn trọng lượng riêng (khối lượng riêng) của xăng dầu nên đám cháy sẽ lan ra

PTHH: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
Ta có: \(n_{Fe}=\dfrac{4,2}{56}=0,075\left(mol\right)\) \(\Rightarrow n_{O_2}=0,05\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,05\cdot22,4=1,12\left(l\right)\) \(\Rightarrow V_{kk}=\dfrac{1,12}{21\%}\approx5,33\left(l\right)\)

Các khí đo ở cùng điều kiện nhiệt độ , áp suất thì tỉ lệ về thể tích cũng là tỉ lệ về số mol
C8H18 + 25/2O2 --> 8CO2 + 9H2O
Theo pt : 1 25/2 8 9 (lít)
Theo đề bài 8 <------100
Theo đề bài 240 ------> 3000
Vậy thể tích khí C8H18 cháy trong 500l không khí tức 100 lít Oxi là 8 lít,
Thể tích oxi cần dùng để đốt cháy hết 240 lít C8H18 là 3000 lít

\(M_{hỗn\ hợp} = 4,5.2 = 9\\ Gọi : n_{CH_4} = a(mol) ; n_{H_2} = b(mol)\\ \Rightarrow 16a + 2b =9(a + b)\ (1) n_{O_2} = \dfrac{56}{5.22,4} = 0,5(mol)\\ CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ 2H_2 + O_2 \xrightarrow{t^o} 2H_2O\\ n_{O_2} = 2a + 0,5b = 0,5(2)\\ (1)(2) \Rightarrow a = 0,2 ; b = 0,2\\ \Rightarrow V = (0,2 + 0,2).22,4 = 8,96(lít)\)

mS= 0,5% . 24=0,12(kg)=120(g)
->nS= 120/32=3,75(mol)
mC=(100% - 2%). 24=23,52(kg)=23520(g)
-> nC= 23520/12=1960(mol)
PTHH: S + O2 -to-> SO2
3,75______________3,75(mol)
C + O2 -to-> CO2
1960______1960(mol)
=> V(SO2,đktc)=3,75 x 22,4=84(l)
V(CO2,đktc)= 1960 x 22,4= 43904(l)

Đổi: 24kg = 24000g
24kg than đá có chứa 0,5% tạp chất lưu huỳnh và 1,5% tạp chất khác không cháy được

⇒ nS = 120 / 32 = 3,75 mol
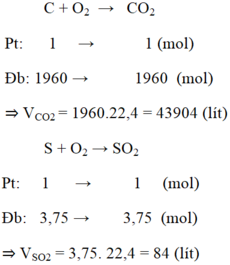

\(m_S=0,5\%.24=0,12\left(kg\right)=120\left(g\right)\\ \Rightarrow n_S=\dfrac{120}{32}=3,75\left(mol\right)\\ m_C=1,5\%.24=0,36\left(kg\right)=360\left(g\right)\\ \Rightarrow n_C=\dfrac{360}{12}=30\left(mol\right)\\ S+O_2\rightarrow\left(t^o\right)SO_2\\ C+O_2\rightarrow\left(t^o\right)CO_2\\ n_{SO_2}=n_S=3,75\left(mol\right)\\ \Rightarrow V_{SO_2\left(đktc\right)}=3,75.22,4=84\left(l\right)\\ n_{CO_2}=n_C=30\left(mol\right)\\ \Rightarrow V_{CO_2\left(đktc\right)}=22,4.30=672\left(l\right)\)
(Chắc đề là 1,5% C)
điều kiện cầ thiết :
- chất cháy nóng đến nhiệt độ cháy
- phải có đủ oxi cho sự cháy