Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trích mẫu thử rồi cho AgNO3 vào lần lượt các dung dịch
- Nhóm 1: có kết tủa trắng xuất hiện là: NaCl, BaCl2.
- Nhóm 2: không có hiện tượng là: NaNO3, Ba(NO3)2.
Ở mỗi nhóm dùng Na2SO4 để phân biệt
- Có kết tủa trắng xuất hiện là: BaCl2.
- Có kết tủa trắng xuất hiện là: Ba(NO3)2

- Trích một ít các chất làm mẫu thử:
- Cho các chất tác dụng với dd HCl dư:
+ Kết tủa trắng: AgNO3
\(AgNO_3+HCl\rightarrow AgCl\downarrow+HNO_3\)
+ Có khí thoát ra: K2CO3
\(K_2CO_3+2HCl\rightarrow2KCl+CO_2\uparrow+H_2O\)
+ Không hiện tượng: NaCl, Ba(NO3)2 (1)
- Cho 2 dd còn lại ở (1) tác dụng với dd K2CO3:
+ Không hiện tượng: NaCl
+ Kết tủa trắng: Ba(NO3)2
\(Ba\left(NO_3\right)_2+K_2CO_3\rightarrow2KNO_3+BaCO_3\downarrow\)

Hãy trình bày phương pháp hóa học nhận biết các dung dịch chứa trong các bình mất nhãn sau :
HCl, HNO3, KCl, KNO3
Trích mỗi lọ 1 ít làm mẫu thử
Cho quỳ tím vào từng mẫu thử
-Nhóm chất nào làm quỳ tím hóa đỏ là HCl và HNO3
-Nhóm chất không làm đổi màu quỳ tím là KCl và KNO3
Cho dd AgNO3 vào nhóm 2 chất làm quỳ tím hóa đỏ
-Chất nào xuất hiện kết tủa trắng là dd HCl
PTHH: AgNO3+HCl---> AgCl\(\downarrow\) + HNO3
-Chất không có hiện tượng là HNO3
Tương tự, ta cho dd AgNO3 vào nhóm 2 chất không làm đổi màu quỳ tím
-Chất nào xuất hiện kết tủa trắng là KCl
PTHH: AgNO3+KCl---> AgCl\(\downarrow\) + KNO3
-Chất còn lại không có hiện tượng là KNO3
Hãy trình bày phương pháp hóa học nhận biết các dung dịch chứa trong các bình mất nhãn sau :
NaCl, NaNO3, BaCl2, Ba(NO3)2

Câu 1:
a, - Cho quỳ tím vào các dung dịch
+ Chuyển thành màu đỏ : H2SO4
+ Chuyển thành màu xanh : Na2SO3, Ba(HSO3)2 (I)
+ Không hiện tượng : Ba(NO3)2,NaCl (II)
- Nhỏ H2SO4 vào (I)
+ Có khí bay lên và kết tủa bền : Ba(HSO3)2
+ Chỉ có khí bay lên : Na2SO3
- Nhỏ H2SO4 lần lượt vào (II)
+ Có kết tủa bền xuất hiện : Ba(NO3)2
+ Không hiện tượng : NaCl
b,
- Cho quỳ tím vào các dung dịch
+ Quỳ tím chuyển thành màu đỏ : NaHSO4
+ Quỳ tím chuyển thành màu xanh : Na2S,Na2SO3 (I)
+ Không hiện tượng : BaCl2
- Nhỏ BaCl2 vào (I)
+ Dd nào tạo kết tủa : Na2SO3
+ Còn lại Na2S
Câu 3:
Cho từng chất lần lượt tác dụng với các chất còn lại
- Chất tác dụng với các chất còn lại cho 2 kết tủa là Ba(OH)2
- Chất tác dụng với 3 chất còn lại xuất hiện kết tủa trắng sau đó hóa nâu đỏ là Fe(NO3)2
- Chất tác dụng với 3 chất còn lại xuất hiện kết tủa trắng là Al2(SO4)3
- Còn lại là NaCl
\(Ba\left(OH\right)_2+Fe\left(NO_3\right)_2\rightarrow Ba\left(NO_3\right)_2+Fe\left(OH\right)_2\)
\(4Fe\left(OH\right)_2+O_2+2H_2O\rightarrow4Fe\left(OH\right)_3\)
\(Ba\left(OH\right)_2+Al_2\left(SO_4\right)_3\rightarrow Al\left(OH\right)_3+BaSO_4\)

c)
- Trích các chất trên thành những mẫu thử nhỏ
- Cho HCl lần lượt vào các mẫu thử
+ Mẫu thử nào tan ra có bọt khí xuất hiện là \(K_2CO_3\)
\(K_2CO_3+2HCl--->2KCl+CO_2+H_2O\)
+ Các mẫu thử khác có phản ứng nhưng không có hiện tượng gì là \(KOH,Ba(OH)_2,K_2SO_4\)
\(KOH+HCl--->KCl+H_2O\)
\(Ba(OH)_2+2HCl--->BaCl_2+2H_2O\)
- Cho \(K_2CO_3\)vừa nhận ra ở trên vào các mẫu thử còn lại
+Mẫu thử nào thấy có xuất hiện kết tủa trắng là \(BaCO_3\)nên chất ban đầu phải là \(Ba(OH)_2\)
\(Ba(OH)_2+K_2CO_3--->BaCO_3+2KOH\)
+ Không có hiện tượng gì là \(KOH ,K_2SO_4\)
- Cho \(Ba(OH)_2\)vừa nhận ra ở trên vào hai mẫu thử còn lại
+ Mẫu thử nào thấy có xuất hiện kết tủa trắng là \(BaSO_4\)nên chất ban đầu phải là \(K_2SO_4\)
\(K_2SO_4+Ba(OH)_2--->BaSO_4+2KOH\)
+ Mẫu thử còn lại không có hiện tượng gì là \(KOH\)

Đáp án D
Lấy BaCl2 cho lần lượt vào 3 mẫu thử.
Các phương trình phản ứng xảy ra:
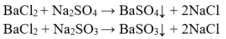
Mẫu không có kết tủa là HCl. Lấy HCl cho vào kết tủa, BaSO3 tan.
![]()

a,
Dung dịch CuCl2 màu xanh.
Cô cạn 3 dd còn lại. Chỉ HCl cô cạn ko có cặn, còn lại có cặn.
Nhỏ CuCl2 vào 2 dd còn lại. KOH có kết tủa xanh lơ, ZnCl2 thì không.
\(ZnCl_2+2KOH\rightarrow Zn\left(OH\right)_2+2KCl\)
b,
Dung dịch Cu(NO3)2 màu xanh.
Cô cạn 3 dd còn lại. Chỉ HCl cô cạn ko có cặn, còn lại có cặn.
Nhỏ Cu(NO3)2 vào 2 dd còn lại. NaOH có kết tủa xanh lơ, AlCl3 thì không.
\(Cu\left(NO_3\right)_2+2NaOH\rightarrow Cu\left(OH\right)_2+2NaNO_3\)
c,
Dung dịch CuSO4 màu xanh.
Nhỏ CuSO4 vào 3 dd còn lại. KOH kết tủa xanh lơ. AgNO3 kết tủa trắng. KCl ko hiện tượng.
\(CuSO_4+2KOH\rightarrow Cu\left(OH\right)_2+K_2SO_4\)
\(2AgNO_3+CuSO_4\rightarrow Cu\left(NO_3\right)_2+Ag_2SO_4\)

Đáp án D
Cho Natri Cacbonat vào các mẫu thử
- mẫu thử nào tạo khí không màu không mùi là HCl
\(Na_2CO_3 + 2HCl \to 2NaCl + CO_2 + H_2O\)
- mẫu thử nào không hiện tượng gì là KCl

Đáp án A
Để phân biệt các dung dịch: H C l , K O H , C a ( N O 3 ) 2 , B a C l 2 người ta dùng quì tím và A g N O 3 vì:
|
|
HCl |
KOH |
C a ( N O 3 ) 2 |
B a C l 2 |
| Quì tím |
Đỏ |
Xanh |
Tím |
Tím |
| A g N O 3 |
x |
x |
Không hiện tượng |
Kết tủa trắng |
Dấu x là đã nhận biết được rồi
Phương trình hóa học: B a C l 2 + 2 A g N O 3 → 2 A g C l ↓ + B a ( N O 3 ) 2
Sử dụng AgNO3 nhé, vì AgCl kết tủa trắng; AgBr kết tủa vàng nhạt; AgI kết tủa vàng đậm nên có thể nhận biết được các dd
1. Có thể dùng chất nào trong các chất sau làm thuốc thử để nhận biết hỗn hợp halogen trong dung dịch ?
A. Ba(OH)2 B. AgNO3 C. Ba(NO3)2 D. Cu(NO3)2