Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trong phản ứng với HCl đặc thì chất nào nhận electron nhiều nhất thì cho lượng Cl2 lớn nhất.
Giả sử có 1 mol mỗi chất CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc thì số mol electron nhận lần lượt là 2 mol, 5 mol, 6 mol, 2 mol.
Vậy chất tạo ra lượng khí Cl2 nhiều nhất là K2Cr2O7. Đáp án B.

Chọn đáp án C
C a O C l 2 + 2HCl → C a C l 2 + C l 2 + H 2 O
1 1 mol
2 K M n O 4 + 16HCl → 2KCl + 2 M n C l 2 + 5 C l 2 + 8 H 2 O
1 2,5 mol
K 2 C r 2 O 7 + 14HCl → 2KCl + 2 C r C l 3 + 3 C l 2 + 7 H 2 O
1 3 mol
M n O 2 + 4HCl → M n C l 2 + C l 2 + 2 H 2 O
1 1 mol
Vậy nếu cho cùng 1 mol mỗi chất C a O C l 2 , K M n O 4 , K 2 C r 2 O 7 , MnO2 thì K 2 C r 2 O 7 cho lượng khí C l 2 nhiều nhất.

a) Giả sử lấy lượng mỗi chất là a gam
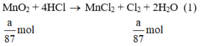
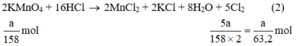
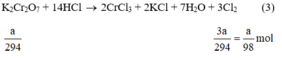
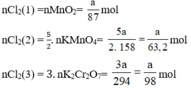
Ta có: 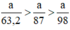
Lượng Cl2 điều chế được từ pt (2) nhiều nhất.
Vậy dùng KMnO4 điều chế được nhiều Cl2 hơn.
b) Nếu lấy số mol các chất bằng a mol
Theo (1) nCl2(1) = nMnO2 = a mol
Theo (2) nCl2(2) = 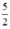 . nKMnO4 = 2,5a mol
. nKMnO4 = 2,5a mol
Theo (3) nCl2(3) = 3. nK2Cr2O7 = 3a mol
Ta có: 3a > 2,5a > a.
⇒ lượng Cl2 điều chế được từ pt (3) nhiều nhất.
Vậy dùng K2Cr2O7 được nhiều Cl2 hơn.

Đáp án B
16HCl + 2KMnO4→ 5Cl2+ 2MnCl2+ 2KCl+8H2O
m/15 → m/63,2
6HCl + KClO3 →3Cl2+ KCl+3H2O
m/122,5→ m/40,8
4HCl + MnO2→ Cl2+ MnCl2+ 2H2O
m/87 → m/87
So sánh thấy nếu lấy cùng 1 lượng các chất phản ứng với HCl thì KClO3 cho nhiều khí Cl2 nhất

a/ \(14HCl+K_2Cr_2O_7\left(\frac{1}{294}\right)\rightarrow3Cl_2\left(\frac{3}{294}\right)+7H_2O+2KCl+2CrCl_3\)(1)
\(4HCl+MnO_2\left(\frac{1}{87}\right)\rightarrow Cl_2\left(\frac{1}{87}\right)+2H_2O+MnCl_2\)(2)
\(16HCl+2KMnO_4\left(\frac{1}{158}\right)\rightarrow5Cl_2\left(\frac{5}{316}\right)+8H_2O+2KCl+2MnCl_2\)(3)
\(n_{K_2Cr_2O_7}=\frac{1}{294}\)
\(\Rightarrow V_1=\frac{3}{294}.22,4=\frac{8}{35}\)
\(n_{MnO_2}=\frac{1}{87}\)
\(\Rightarrow V_2=\frac{1}{87}.22,4=\frac{112}{435}\)
\(n_{KMnO_4}=\frac{1}{158}\)
\(\Rightarrow V_3=\frac{5}{316}.22,4=\frac{28}{79}\)
\(\Rightarrow\)Vậy thể tích Cl2 thu ở phản ứng (2) là nhiều nhất
b/ Dựa vào PTHH câu a ta có:
\(n_{Cl_2\left(V_1\right)}=3.0,1=0,3\)
\(n_{Cl_2\left(V_2\right)}=0,1.1=0,1\)
\(n_{Cl_2\left(V_3\right)}=\frac{0,1.5}{2}=0,25\)
Vậy thể tích Cl2 ở phản ứng đầu là lớn nhất

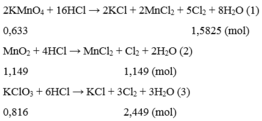
2KMnO4+ 16HCl => 2MnCl2+ 2KCl+ 5Cl2+ 8H2O
1_____________________________2.5
MnO2+ 4HCl => MnCl2+ Cl2+ 2H2O
1_____________________1
KClO3+ 6HCl => KCl+ 3Cl2+ 3H2O
1___________________3
CaOCl2 + 2HCl => CaCl2 + Cl2 + H2O
1_______________________1
=> KClO3 điều chế Cl2 nhiều nhất

2KMnO4 + 16HCl -> 5Cl2 + 8H2O + 2KCl + 2MnCl2
a -> 2,5a
MnO2 + 4HCl -> Cl2 + 2H20 + MnCl2
a -> a
KClO3 + 6HCl -> 3Cl2 + 3H2O + KCl
a -> 3a
CaOCl2 + 2HCl -> Cl2 + H2O + CaCl2
a -> a
So sánh ta thấy cùng một lượng a mol thì KClO3 tác dụng với HCl cho nhiều Clo nhất
Cùng lấy một lượng a mol thì chất nào sau đây khi tác dụng hết với dung dịch HCl đặc , lấy vừa đủ thu được lượng khí clo nhiều nhất ?
A.KMnO4 ; B. MnO2 ; C.KClO3 ; D. CaOCl2
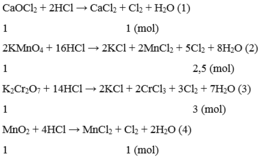



1)
Theo pt:
-1mol CaOCl2 sẽ tạo ra 1mol Cl2
-1mol KMnO4 sẽ tạo ra 2,5mol Cl2
-1mol K2Cr2O7 sẽ tạo ra 3mol Cl2
-1mol MnO2 sẽ tạo ra 1mol Cl2
Vậy K2Cr2O7 tạo ra lượng khí clo nhiều nhất,CaOCl2 và MnO2 tạo ra lượng khí clo ít nhất
Theo đề, ta có: \(n_{CaOCl_2}=\dfrac{100}{127}\left(mol\right)\\ n_{KMnO_4}=\dfrac{100}{158}=\dfrac{50}{79}\left(mol\right)\\ n_{K_2Cr_2O_7}=\dfrac{100}{294}=\dfrac{50}{147}\left(mol\right)\\ n_{MnO_2}=\dfrac{100}{87}\left(mol\right)\)|
\(CaOCl_2+2HCl\rightarrow Cl_2+H_2O+CaCl_2\)
\(16HCl+2KMnO_4\rightarrow5Cl_2+8H_2O+2KCl+2MnCl_2\)
\(14HCl+K_2Cr_2O_7\rightarrow3Cl_2+7H_2O+2KCl+2CrCl_3\)
\(4HCl+MnO_2\rightarrow MnCl_2+2H_2O\)
Theo phương trình:
- \(\dfrac{100}{127}mol\) CaOCl2 sẽ tạo ra \(\dfrac{100}{127}mol\) Cl2.
- \(\dfrac{100}{158}mol\) KMnO4 sẽ tạo ra \(\dfrac{125}{79}mol\) Cl2.
- \(\dfrac{100}{294}mol\) K2Cr2O7 sẽ tạo ra \(\dfrac{50}{49}mol\) Cl2.
- \(\dfrac{100}{87}mol\) MnO2 sẽ tạo ra \(\dfrac{100}{87}mol\) Cl2.
Vậy 100(g) KMnO4 sẽ tạo ra lượng Cl2 nhiều nhất, 100(g) CaOCl2 sẽ tạo ra lượng Cl2 ít nhất.