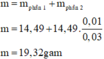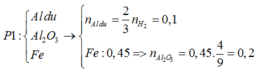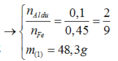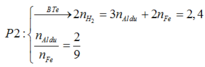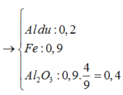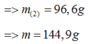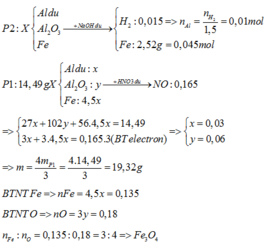Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Cr}=y\left(mol\right)\end{matrix}\right.\) (trong 1 phần)
_ Phần 1: nH2 = 0,2 (mol)
BT e, có: 3x + 2y = 0,2.2 (1)
_ Phần 2: nH2 = 0,15 (mol)
BT e, có: 3x = 0,15.2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,05\left(mol\right)\end{matrix}\right.\)
⇒ m = 2.(0,1.27 + 0,05.52) = 10,6 (g)
→ Đáp án: A
Bạn tham khảo nhé!

Đáp án B
► Xét phần 1: Y + NaOH → H2.
Mặt khác, phản ứng xảy ra hoàn toàn ⇒ Al dư.
nAl dư = 0,15 ÷ 1,5 = 0,1 mol. Phần không tan T là Fe
⇒ nFe = nH2 = 0,45 mol.
Lần lượt bảo toàn nguyên tố Oxi và Fe
⇒ nAl2O3 = 0,2 mol.
● GIẢ SỬ phần 1 tác dụng với HCl thì nH2 = 0,1 × 1,5 + 0,45 = 0,6 mol.
||⇒ phần 2 gấp 1,2 ÷ 0,6 = 2 lần phần 1
⇒ lượng ban đầu gấp 3 lần phần 1.
► m = 3 × (0,1 × 27 + 0,2 × 102 + 0,45 × 56) = 144,9(g)

Đáp án B
Phương pháp: Do P1+NaOH sinh ra H2 nên trong phản ứng nhiệt nhôm l dư.
Chú ý: Chia thành 2 phần không bằng nhau.
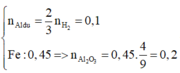
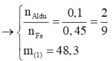
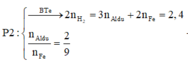

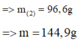

Đáp án A
Số mol OH- = 0,5 . 0,4 = 0,2 mol mà số mol kết tủa Fe(OH)3 = 0,05 mol
Nên có 0,15 mol OH- tạo kết tủa và 0,05 mol OH- trung hòa lượng H+ còn lại.
Vậy số mol OH- dư trong Y là 0,05 . 2 = 0,1 mol → nên số H+ phản ứng là 0,6 mol H+.
Lập hệ số mol Fe là x ; Fe3O4 là y
⇒ 56x + 232y = 10,24
Bảo toàn e cho nhận: 3x + y = 0,3 + a
Số mol H+ phản ứng: 4.nNO + 2.nNO2 + 8.nFe3O4= 0,6 mol
→ 4.0,1 + 2a + 8y =0,6
Giải hệ ta được: a = 0,02; x = 0,1; y = 0,02 mol
Vậy nếu phản ứng với Ba(OH)2 dư thì sẽ có 0,08 mol Fe(OH)3; 0,05 mol BaSO4
Nên khối lượng là: 20,21 gam. (Chia 2 vì chỉ lấy 1 nửa dung dịch).

Đáp án C
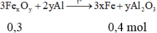
· Phần 2: + NaOH ® 0,015 mol H2
Þ Chứng tỏ phản ứng dư Al, oxit sắt phản ứng hết.
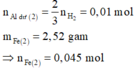
· Phần 1: 14,49 gam Y + HNO3 loãng, dư ® 0,165 mol NO.
Áp dụng bảo toàn electron có:

![]()
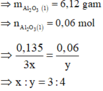
Þ Công thức oxit sắt là Fe3O4.