Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Hợp chất X : $R_2O_5$(lập CTHH dựa quy tắc hóa trị)
$M_X = 2R + 5O = 2R + 16.5 = 142\ đvC \Rightarrow R = 31(đvC)$
Vậy R là nguyên tố Photpho, CTHH X : $P_2O_5$
Hợp chất Y : $A_2(SO_4)_a$(lập CTHH dưa quy tắc hóa trị )
$M_Y = 2A + 96a =142 : 0,355 = 400\ đvC$
Với a = 1 thì A = 152 - loại
Với a = 2 thì A = 104 - loại
Với a = 3 thì A = 56 (Fe)
Vậy A là nguyên tố Fe, CTHH Y : $Fe_2(SO_4)_3$

Gọi công thức của A là H 3 X O y (vì nhóm X O y hóa trị III nên theo quy tắc hóa trị ta xác định được phân tử có 3 nguyên tử H)
Phân tử khối của H 2 S O 4 : 2 + 32 + 16.4 = 98 (đvC)
Vì A nặng bằng phân tử H 2 S O 4 nên PTK của A là 98 đvC
Theo đề bài, ta có khối lượng của nguyên tố oxi trong hợp chất là:
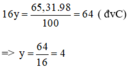
→ có 4 nguyên tử oxi trong hợp chất A.
Vậy nguyên tử khối của X là: 98 – (3 + 64) = 31 (đvC)

Tên nguyên tố là photpho, kí hiệu hóa học là P.
Công thức hóa học của A là H 3 P O 4

a. gọi hóa trị của \(X\) và \(Y\) là \(x\)
\(\rightarrow X_1^xO^{II}_1\rightarrow x.1=II.1\rightarrow x=II\)
vậy \(X\) hóa trị \(II\)
\(\rightarrow Y_1^x\left(OH\right)^I_3\rightarrow x.1=I.3\rightarrow x=III\)
vậy \(Y\) hóa trị \(III\)
ta có: \(X_x^{II}Y^{III}_y\rightarrow II.x=III.y\)
\(\rightarrow\dfrac{x}{y}=\dfrac{III}{II}=\dfrac{3}{2}\rightarrow\left[{}\begin{matrix}x=3\\y=2\end{matrix}\right.\)
\(\rightarrow CTHH:X_3Y_2\)
b. ta có:
\(2X+1O=62\)
\(2X+1.16=62\)
\(2X=62-16\)
\(2X=46\)
\(X=\dfrac{46}{2}=23\left(đvC\right)\)
\(\Rightarrow X\) là\(Na\left(Natri\right)\)
\(\rightarrow CTHH:Na_2O\)

Câu 1:
\(a)\) Theo đề, ta có công thức tổng quát của A là \(X_2O_3\)
\(2X+16.3=102\)
\(<=> 2X=54\)
\(<=> X=27\) \((Al)\)
Vậy CTPT của A là \(Al_2O_3\)
Ta có: công thức tổng quát của B theo đề bài: \(Y_2(SO_4)_y\)
Mà \(M_B=\dfrac{M_A}{0,255}=\dfrac{102}{0,255}=400 (đvC)\)
\(2Y+96y=400\)
Theo đề \(1\le y\le3\)
Với y = 1 thì Y = 152 (loại)
y = 2 thì Y = 104 (loại)
y = 3 thì Y = 56 (nhận)
Vậy kim loại Y cần tìm là Fe có hóa trị III
=> CTPT của B là \(Fe_2(SO_4)_3\)
\(b)\) Gọi x là số gam H2O cần thêm vào
Khối lượng NaCl trước khi thêm vào là:
\(mNaCl(truoc)=\dfrac{10.250}{100} = 25 (g)\)
Sau khi thêm vào thì khối lượng Natri-Clorua không thay đổi:
\(=> mNaCl(truoc)=mNaCl(sau)=25(g)\)
Khối lượng dung dich sau khi thêm nước vào là:
\(mdd(sau) = 250+x (g)\)
Ta có: \(8=\dfrac{25.100}{250+x}\)
\(=> x=62,5(g)\)
Vậy cần thêm vào 62,5 g H2O để có dung dich NaCl 8%
bạn ơi nguyên tử khối hợp chất A là 102 đvC k phải 142